题目内容
5.如图为元素周期表前三周期的一部分.
(1)X的氢化物的沸点与W的氢化物比较,沸点较高的是:NH3(填化学式),原因是NH3分子间易形成氢键.
(2)从下列选项中选出X的基态原子的最外层原子轨道表示式B,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合D.(填序号).
A.
 B.
B. C.泡利原理 D.洪特规则
C.泡利原理 D.洪特规则(3)以上W、Y、R元素原子失去核外第一个电子需要能量由多到少的顺序为:Ar>P>S(填元素符号).
分析 如图为元素周期表前三周期的一部分,由元素在周期表的位置可知,R为Ar,X为N,W为P,Y为S,Z为F,
(1)分子的相对分子质量越大,分子间作用力越大,氢化物的沸点越高;
(2)X的基态原子的最外层有5个电子,由洪特规则可知3p电子优先占据一个轨道;
(3)元素原子失去核外第一个电子需要的能量为第一电离能,非金属性越强,第一电离能越弱.
解答 解:如图为元素周期表前三周期的一部分,由元素在周期表的位置可知,R为Ar,X为N,W为P,Y为S,Z为F,
(1)X、W的氢化物分别为NH3、PH3,NH3分子间易形成氢键,分子间作用力大,氢化物的沸点高,故氢化物的沸点大小顺序为PH3<NH3;
故答案为:NH3;NH3分子间易形成氢键;
(2)X为N元素,N的基态原子的最外层有5个电子,由洪特规则可知3p电子优先占据一个轨道,X的基态原子的最外层原子轨道表示式为 ,另一原子轨道表示式违反了洪特规则,
,另一原子轨道表示式违反了洪特规则,
故答案为:B;D;
(3)R为Ar,W为P,Y为S,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关,结构越稳定失电子所需能量越高,R元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多;P的非金属性较强,其失去电子能力越弱,失去核外第一个电子需要能量越大,则原子失去核外第一个电子需要能量由多到少的顺序为:Ar>P>S,
故答案为:Ar>P>S.
点评 本题考查位置、结构与性质关系的应用,为高频考点,把握元素的位置、元素的性质及原子结构为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.A、B、C、X、Y、Z是元素周期表中的前20号元素,且原子序数依次增大.已知它们的部分化合物的性质如下:
回答下列问题:
(1)写出对应元素的名称:A碳、B氮、C氟、X铝、Y硅、Z氯
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):Ca>Al>Si
(3)写出B的氢化物与C的氢化物反应后生成物的电子式: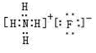 .
.
(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:2F2+2H2O=4HF+O2.
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和“>“、“<“或“=“表示:)CO2<SiO2并说明理由CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
| A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
| 含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
(1)写出对应元素的名称:A碳、B氮、C氟、X铝、Y硅、Z氯
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):Ca>Al>Si
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:
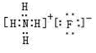 .
.(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:2F2+2H2O=4HF+O2.
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和“>“、“<“或“=“表示:)CO2<SiO2并说明理由CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
1.下列关于有机化合物的说法正确的是 ( )
| A. | 2-甲基丁烷的一溴代物有4种 | |
| B. | 乙烯和聚氯乙烯都能使溴水褪色 | |
| C. | 乙醇、乙酸既可用NaOH区分,也可以用小苏打区分 | |
| D. | 乙酸乙酯既能发生加成反应又能发生水解反应 |
13.下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀.
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀.
| A. | ①②③ | B. | ②③⑤ | C. | ②③④ | D. | 全部 |
20.500mL KNO3和 Cu(NO3)2的混合溶液中 c(NO3-)=6mol•L-1,用石墨做电极电解此混合溶液,通电一段时间后,两极均收集到 22.4L(标准状况)气体,假定电解后溶液体积仍为 500mL,下列说法正确的是( )
| A. | 原混合溶液中 c(K+)为 2 mol•L-1 | |
| B. | 电解过程中共转移 8 mol电子 | |
| C. | 电解得到的Cu 的物质的量为 0.5 mol | |
| D. | 电解后溶液中的 c(H+)为 2 mol•L-1 |
17.下列说法一定不正确的是( )
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn ),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是 222 | |
| B. | Se 是人体必需的微量元素,${\;}_{34}^{78}$Se 和${\;}_{34}^{80}$Se 互为同位素 | |
| C. | ${\;}_{92}^{235}$U 的浓缩一直被国际社会关注,${\;}_{92}^{235}$U 与 ${\;}_{92}^{238}$U 是两种不同的核素 | |
| D. | ${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C 的中子数为 6 |
14.针对实验室制取氨气,下列说法错误的是( )
| A. | 发生装置与用KClO3制取O2的装置相同 | |
| B. | 可用浓硫酸干燥氨气 | |
| C. | 可用向下排空气法收集氨气 | |
| D. | 氨气的验满可以用蘸有浓盐酸的玻璃棒放于试管口附近 |
15.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 碳棒作电极电解饱和食盐水,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| B. | 由C(石墨)(s)═C(金刚石)(s)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 粗铜精炼时,与电池正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 |
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.