题目内容
下列叙述不正确的是( )
| A、0.1 mol?L-1NaOH溶液与0.2 mol?L-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.2 mol?L-1 |
| B、常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ |
| D、25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=14 |
考点:酸碱混合时的定性判断及有关ph的计算,pH的简单计算
专题:
分析:A、0.1mol/L的NaOH溶液与0.2mol/L的醋酸溶液混合后,注意溶液体积的变化对浓度的影响;
B、根据溶液的电荷守恒了物料守恒来分析;
C、相同pH的(NH4)2SO4与NH4Cl溶液的酸性时由其水解导致的,而NH4HSO4电离时产生H+使溶液呈酸性,以此来解答.
D、盐酸和氢氧化钡溶液等体积混合恰好完全反应,则氢氧根与氢离子的物质的量相等,根据溶液的pH计算出a+b.
B、根据溶液的电荷守恒了物料守恒来分析;
C、相同pH的(NH4)2SO4与NH4Cl溶液的酸性时由其水解导致的,而NH4HSO4电离时产生H+使溶液呈酸性,以此来解答.
D、盐酸和氢氧化钡溶液等体积混合恰好完全反应,则氢氧根与氢离子的物质的量相等,根据溶液的pH计算出a+b.
解答:
解:A、0.1mol/L的NaOH溶液与0.2mol/L的醋酸溶液混合后,注所得混合溶液中的溶质是0.05mol/L的CH3COONa和0.05mol/L的CH3COOH,根据物料守恒可知:c(CH3COOH)+c(CH3COO-)=0.1 mol?L-1,故A错误;
B、由于混合后呈中性,故加入的HCl的量远小于CH3COONa的量,故(Na+)>c(Cl-);所得溶液中的溶质有:CH3COONa、CH3COOH和NaCl,根据电荷守恒有:
c(H+)+c(Na+)=c(OH-)+c(CH3COO-)+c(Cl-),由于溶液呈中性,故有:c(H+)=c(OH-),从而可知:c(Na+)=c(CH3COO-)+c(Cl-) ①;
而根据溶液中所有的Na+、CH3COO-和CH3COOH均来自于CH3COONa可知:c(Na+)=c(CH3COO-)+c(CH3COOH) ②,结合①②可知c(Cl-)=c(CH3COOH),故B正确;
C、相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,故顺序为:①=②>③,故C正确;
D、pH=a的盐酸中氢离子浓度为10-amol/L,pH=b的氢氧化钡溶液中氢氧根离子浓度为:10b-14mol/L,两溶液等体积混合后恰好完全反应,则氢离子和氢氧根的物质的量的一定相等,即:10-amol/L×V=10b-14mol/L×V,则a+b=14,故D正确;
故选A.
B、由于混合后呈中性,故加入的HCl的量远小于CH3COONa的量,故(Na+)>c(Cl-);所得溶液中的溶质有:CH3COONa、CH3COOH和NaCl,根据电荷守恒有:
c(H+)+c(Na+)=c(OH-)+c(CH3COO-)+c(Cl-),由于溶液呈中性,故有:c(H+)=c(OH-),从而可知:c(Na+)=c(CH3COO-)+c(Cl-) ①;
而根据溶液中所有的Na+、CH3COO-和CH3COOH均来自于CH3COONa可知:c(Na+)=c(CH3COO-)+c(CH3COOH) ②,结合①②可知c(Cl-)=c(CH3COOH),故B正确;
C、相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,故顺序为:①=②>③,故C正确;
D、pH=a的盐酸中氢离子浓度为10-amol/L,pH=b的氢氧化钡溶液中氢氧根离子浓度为:10b-14mol/L,两溶液等体积混合后恰好完全反应,则氢离子和氢氧根的物质的量的一定相等,即:10-amol/L×V=10b-14mol/L×V,则a+b=14,故D正确;
故选A.
点评:本题考查了pH的简单计算、酸碱混合的定性判断,题目难度中等,注意有关溶液pH的计算方法,明确溶液酸碱性与溶液pH的关系,选项A为易错点,应注意混合后溶液体积的变化对浓度的影响.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
下列各组物质的性质比较中不正确的是( )
| A、酸性:HClO4>H2SO4>H3 PO4 |
| B、热稳定性:SiH4>PH3>H2 S |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、氧化性:F2>C12>Br2 |
下列离子方程式中,正确的是( )
| A、稀硫酸与氢氧化钡溶液反应:Ba2++SO42-?BaSO4↓ |
| B、稀盐酸滴在铜片上:Cu+2H+?Cu2++H2↑ |
| C、小苏打与氢氧化钠溶液混合:HCO3-+OH-?CO2↑+H2O |
| D、氧化铜与稀硫酸混合:CuO+2H+?Cu2++H2O |
室温下,将一元酸HA溶液和NaOH溶液等体积混合,实验数据如表:下列说法正确的是( )
| 实验编号 | 起始浓度c(HA) | 起始浓度c(NaOH) | 反应后溶液的pH |
| ① | 0.2mol?L-1 | 0.2mol?L-1 | 9 |
| A、HA是一元强酸 |
| B、反应后溶液中c(A-)>c(Na+) |
C、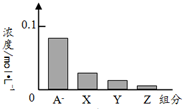 若用如图来表示反应后各微粒的关系,则图中X 表示OH-,Y表示HA,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)>c(Na+) |
甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连.则下列叙述不正确的是( )


| A、甲是化学能转变为电能,乙、丙是电能转变为化学能 |
| B、C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应 |
| C、C1和C3放出的气体相同,铜片和铁片放出的气体也相同 |
| D、甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小 |
某无色溶液用惰性电极电解时,有如下两个实验现象:(1)阳极上有无色气体产生;(2)阴极上有白色沉淀生成;此溶液中可能大量共存的离子是( )
| A、Na+、Ba2+、NO3-、Cl- |
| B、NO3-、Mg2+、Na+、SO42- |
| C、CO32-、K+、Cl-、Na+ |
| D、Fe2+、NO3-、SO42-、Na+ |