题目内容
下列各组物质的性质比较中不正确的是( )
| A、酸性:HClO4>H2SO4>H3 PO4 |
| B、热稳定性:SiH4>PH3>H2 S |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、氧化性:F2>C12>Br2 |
考点:同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.元素的非金属性越强,对应的单质的氧化性越强.
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.元素的非金属性越强,对应的单质的氧化性越强.
解答:
解:A.非金属性:P<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H3PO4<H2SO4<HClO4,故A正确;
B.非金属性:Si<P<S,元素的非金属性越强,对应的氢化物越稳定,所以热稳定性:SiH4<PH3<H2S,故B错误;
C.金属性:Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,所以碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
D.非金属性:F>C1>Br,元素的非金属性越强,对应的单质的氧化性越强,所氧化性:F2>C12>Br2,故D正确;
故选:B.
B.非金属性:Si<P<S,元素的非金属性越强,对应的氢化物越稳定,所以热稳定性:SiH4<PH3<H2S,故B错误;
C.金属性:Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,所以碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
D.非金属性:F>C1>Br,元素的非金属性越强,对应的单质的氧化性越强,所氧化性:F2>C12>Br2,故D正确;
故选:B.
点评:本题考查元素周期律知识,题目难度不大,注意相关基础知识的积累,特别是判断金属性、非金属性的角度.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列说法错误的是( )
| A、硝酸的摩尔质量和6.02×1023个硝酸分子的质量(以克为单位)在数值上相等 |
| B、6.02×10个氮气分子和6.02×1023个氢气分子的质量比等于14:1 |
| C、32g氧气所含的原子数目约为2×6.02×1023 |
| D、通常情况下,近似值6.02×1023就是我们所说的阿伏伽德罗常数 |
将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是( )
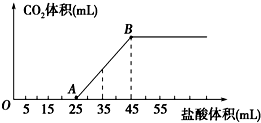

| A、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3- |
| B、当加入35mL盐酸时,产生CO2的体积为224mL |
| C、A点溶液中的溶质为NaC1、NaHCO3 |
| D、混合物中NaOH的质量0.60g |
下列表示对应化学反应的离子方程式正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、向40 mL 8 mol/L的稀硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
下列叙述不正确的是( )
| A、0.1 mol?L-1NaOH溶液与0.2 mol?L-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.2 mol?L-1 |
| B、常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ |
| D、25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=14 |