题目内容
16. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数作相应的加减;
(2)在加热条件下,C与CuO也能生成Cu;
(3)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,根据得失电子守恒分析;
(4)阴极上氢离子得电子生成氢气,阳极上Cu失电子生成Cu2O;
(5)a.根据温度对化学平衡移动的影响知识来回答;
b.根据反应速率v=$\frac{△c}{△t}$来计算;
c.催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快;
d.k只与温度有关,温度越高,k越大.
解答 解:(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-akJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-bkJ•mol-1,
③Cu(s)+$\frac{1}{2}$O2(g)=CuO(s);△H=-ckJ•mol-1
由盖斯定律可知,①-③×2+②得2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1;
故答案为:2c-a-b;
(2)在加热条件下,C与CuO也能生成Cu,所以若温度不当,会生成Cu,故答案为:若温度不当,会生成Cu;
(3)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,其反应的方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑;
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑;
(4)阴极上氢离子得电子生成氢气,阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极发生氧化反应,碱性条件下Cu在阳极失去电子得到Cu2O与H2O,阳极电极反应式为:2Cu-2e-+2OH-=Cu2O+H2O;
故答案为:阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O;
(5)a.实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高,所以T2>T1,故a错误;
b.实验①前20min的平均反应速率 v(H2)=$\frac{△c}{△t}$=$\frac{0.05mol/L-0.0486mol/L}{20min}$=7×10-5 mol•L-1 min-1,则v(O2)=$\frac{1}{2}$v(H2)=3.5×10-5mol/(L.min),故b错误;
c.②③化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,③中水蒸气的浓度变化比②快,则实验②比实验①所用的Cu2O催化效率高,故c正确;
d.该反应为吸热反应,温度越高,k越大,由a分析可知,T2>T1,所以实验①、②、③的化学平衡常数的关系:K1=K2<K3,故d正确;
故答案为:cd.
点评 本题考查盖斯定律的应用、电解原理的应用、氧化还原反应方程式的书写和配平、化学反应速率的计算以及化学平衡移动、平衡常数等,题目综合性较大,难度中等,是对知识的综合运用,注意基础知识的理解掌握.

| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | 非金属性:Z>W | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
| A. | 由于水解,溶液中n(SO32-)<0.1mol | |
| B. | 加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| C. | c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-) | |
| D. | 2c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
| A. | 标准状况下,22.4L SO3 中所含分子数为NA | |
| B. | 含1mol硅原子的SiO2晶体中Si-O键的个数为4NA | |
| C. | 10L PH=1的硫酸溶液中含有的H+离子数为2NA | |
| D. | 1L 1 mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA |
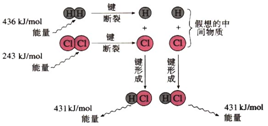
H2(g)+Cl2(g)═2HCl(g)反应的能量变化示意图
下列说法正确的是( )
| A. | 氯化氢分子的电子式: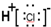 | |
| B. | 该反应是工业制取盐酸的化学反应原理 | |
| C. | 形成1molH-Cl键要吸收431 kJ的能量 | |
| D. | 该反应中反应物总能量小于生成物总能量 |
 NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )
NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )| A. | a点的溶液中:c(SO42-)>c(NH4+)>c(H+)>c(Na+)>c(OH-) | |
| B. | b点的溶液中:c(Na+)=c(SO42-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | c点的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | d、e点对应溶液中,水电离程度大小关系是d>e |
| A. | 单质的沸点:Z>X>Y | |
| B. | 单质的氧化性:W<Z<Y<X | |
| C. | 气态氢化物的稳定性:W>X>Y>Z | |
| D. | W单质可以将X从其盐溶液中置换出来 |
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | 乙醇氧化成乙醛的化学方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 乙酸与乙醇发生酯化反应:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$CH3COOCH2CH3 | |
| D. | CaCO3高温分解的热化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,△H=+178.5 kJ•mol-1 |