题目内容
6.已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是( )| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | 非金属性:Z>W | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
分析 W、X、Y、Z为短周期元素,W、Z同主族,W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,故W、Z为非金属,原子序数Z>W,W处于第二周期,Z处于第三周期,X、Y、Z同周期,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,则原子序数Y>X,且二者处于第三周期,然后结合元素周期律及元素化合物来解答.
解答 解:W、X、Y、Z为短周期元素,W、Z同主族,W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,故W、Z为非金属,原子序数Z>W,W处于第二周期,Z处于第三周期,X、Y、Z同周期,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,则原子序数Y>X,且二者处于第三周期,X、Y、Z的原子序数Z>Y>X,
A.W、Z同主族,原子序数Z>W,X、Y、Z同周期,X、Y、Z的原子序数Z>Y>X,所以原子半径X>Y>Z>W,故A正确;
B.若W与X形成的化合物为过氧化钠,既含离子键又含共价键,故B错误;
C.由上述分析可知,W处于第二周期,Z处于第三周期,若W为F时,非金属性:Z<W,故C错误;
D.若W为N元素,Y为Mg元素,二者的原子序数相差5,二者形成化合物的化学式可能为Mg3N2,为Y3W2,故D错误;
故选A.
点评 本题考查位置、结构与性质的关系,为高频考点,把握短周期、氢化物稳定性及阳离子氧化性比较推断元素的位置为解答该题的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
16.下列表示方法正确的是( )
①CH4分子的比例模型:
②四氯化碳分子的电子式为:
③乙烯的结构简式 CH2CH2
④丙烷分子的球棍模型
①CH4分子的比例模型:

②四氯化碳分子的电子式为:

③乙烯的结构简式 CH2CH2
④丙烷分子的球棍模型

| A. | ①④ | B. | ①②④ | C. | ①②③④ | D. | ②③ |
17.下面的排序不正确的是( )
| A. | 沸点由高到低:HF>HCl | B. | 熔点由高到低:K>Li | ||
| C. | 硬度由大到小:金刚石>晶体硅 | D. | 晶格能由大到小:NaF>NaCl |
1.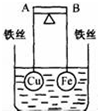 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A 端高B 端低 | |
| B. | 杠杆为导体和绝缘体时,均为A 端低B 端高 | |
| C. | 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 | |
| D. | 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
11.下列有关物质性质的说法错误的是( )
| A. | 非金属性:Cl>I | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:H2SO3>H2SO4 | D. | 结合H+能力:CO32->Cl- |
18.硼酸(H3BO3)微溶于水,其水溶液显弱酸性,对人体的受伤组织有防腐作用.工业上以硼镁矿(Mg2B2O5•H2O)为原料生产硼酸,同时以硼镁泥为原料制取硫酸镁,可用于印染、造纸、医药等工业.生产工艺流程如下图所示,请回答下列问题:
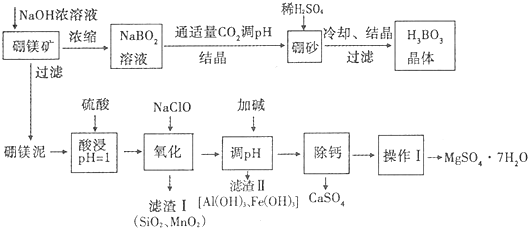
注:
①硼镁泥的主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.
②硼酸电离平衡常数K=5.8×10-10
③
④已知MgSO4、CaSO4的溶解度如下表:
(1)写出上述流程中生成硼砂(Na2B4O7)的离子方程式4BO2-+CO2=B4O72-+CO32-
(2)硼酸根离子可表示为B(OH)4-.写出硼酸电离的方程式H3BO3+H2O?B(OH)4-+H+
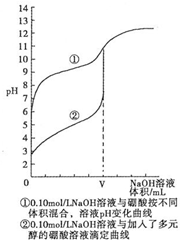
(3)N滴定法测定硼酸晶体的纯度.研究结果表明,用0.1mol•L-1NaOH溶液直接滴定硼酸溶液,滴定过程如曲线①所示,向硼酸溶液中加入多元醇后再滴定如曲线②所示.请分析,能否用强碱直接滴定硼酸溶液,不能 (填“能”或“不能”),理由是:没有明显的pH突变区域,无法判断终点,会造成较大的误差
(4)向硼镁泥酸浸后的溶液中,加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是ClO-+Mn2++H2O=MnO2↓+Cl-+2H+.
(5)加碱调节至pH为4.7时,杂质离子便可完全沉淀.(离子浓度小于或等于1×l0-5mol•L-1时,即可认为该离子沉淀完全)
(6)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤蒸发浓缩结晶、趁热过滤.

注:
①硼镁泥的主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.
②硼酸电离平衡常数K=5.8×10-10
③
| 化合物 | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp近似值 | 10-11 | 10-16 | 10-38 | 10-33 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(2)硼酸根离子可表示为B(OH)4-.写出硼酸电离的方程式H3BO3+H2O?B(OH)4-+H+
(3)N滴定法测定硼酸晶体的纯度.研究结果表明,用0.1mol•L-1NaOH溶液直接滴定硼酸溶液,滴定过程如曲线①所示,向硼酸溶液中加入多元醇后再滴定如曲线②所示.请分析,能否用强碱直接滴定硼酸溶液,不能 (填“能”或“不能”),理由是:没有明显的pH突变区域,无法判断终点,会造成较大的误差
(4)向硼镁泥酸浸后的溶液中,加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是ClO-+Mn2++H2O=MnO2↓+Cl-+2H+.
(5)加碱调节至pH为4.7时,杂质离子便可完全沉淀.(离子浓度小于或等于1×l0-5mol•L-1时,即可认为该离子沉淀完全)
(6)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤蒸发浓缩结晶、趁热过滤.

15.下表是 25℃时某些弱酸的电离平衡常数.
下列有关说法不正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
| A. | 若H2C2O4 与等物质的量的 KOH反应后所得溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为:c(K+)>c( HC2O4-)>c( H+)>c( C2O42-)>c( OH-) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O=Cl-+HClO+HCO3- | |
| C. | 常温下,0.1mol/LCH3COOH 溶液加水稀释过程中,表达式c( H+)/c( CH3COOH )的数据变大 | |
| D. | pH相同的 NaClO 和 CH3COOK 溶液,其溶液的物质的量浓度的大小关系是:c( CH3COOK )>c( NaClO ) |
16. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
下列叙述正确的是cd(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
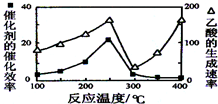
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 CH4和CO2可以制造价值更高的化学产品.已知:
CH4和CO2可以制造价值更高的化学产品.已知: