题目内容
7.有关0.1mol/LNa2SO3溶液的说法正确的是( )| A. | 由于水解,溶液中n(SO32-)<0.1mol | |
| B. | 加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| C. | c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-) | |
| D. | 2c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
分析 A.溶液体积不明确;
B.加入氢氧化钠固体,钠离子浓度肯定增大,OH-抑制水解;
C.根据电荷守恒解题;
D.根据物料守恒解题.
解答 解:A.由于溶液体积不明确,故溶液中的n(SO32-)无法计算,故A错误;
B.加入氢氧化钠固体,钠离子浓度肯定增大,OH-抑制水解,所以SO32-的浓度增大,故B正确;
C.电荷守恒,HSO3-带一个电荷,不应该在其浓度前面乘以2,正确为:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故C错误;
D.物料守恒,正确的写法c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],故D错误.
故选B.
点评 本题考查盐类的水解、物料守恒和电荷守恒,难度不大,注意掌握物料守恒和电荷守恒.

练习册系列答案
相关题目
17.下面的排序不正确的是( )
| A. | 沸点由高到低:HF>HCl | B. | 熔点由高到低:K>Li | ||
| C. | 硬度由大到小:金刚石>晶体硅 | D. | 晶格能由大到小:NaF>NaCl |
18.硼酸(H3BO3)微溶于水,其水溶液显弱酸性,对人体的受伤组织有防腐作用.工业上以硼镁矿(Mg2B2O5•H2O)为原料生产硼酸,同时以硼镁泥为原料制取硫酸镁,可用于印染、造纸、医药等工业.生产工艺流程如下图所示,请回答下列问题:
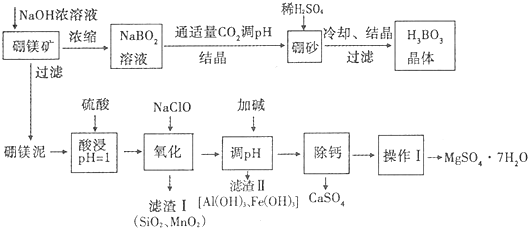
注:
①硼镁泥的主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.
②硼酸电离平衡常数K=5.8×10-10
③
④已知MgSO4、CaSO4的溶解度如下表:
(1)写出上述流程中生成硼砂(Na2B4O7)的离子方程式4BO2-+CO2=B4O72-+CO32-
(2)硼酸根离子可表示为B(OH)4-.写出硼酸电离的方程式H3BO3+H2O?B(OH)4-+H+
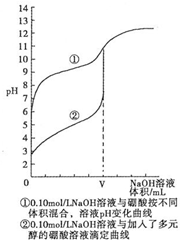
(3)N滴定法测定硼酸晶体的纯度.研究结果表明,用0.1mol•L-1NaOH溶液直接滴定硼酸溶液,滴定过程如曲线①所示,向硼酸溶液中加入多元醇后再滴定如曲线②所示.请分析,能否用强碱直接滴定硼酸溶液,不能 (填“能”或“不能”),理由是:没有明显的pH突变区域,无法判断终点,会造成较大的误差
(4)向硼镁泥酸浸后的溶液中,加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是ClO-+Mn2++H2O=MnO2↓+Cl-+2H+.
(5)加碱调节至pH为4.7时,杂质离子便可完全沉淀.(离子浓度小于或等于1×l0-5mol•L-1时,即可认为该离子沉淀完全)
(6)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤蒸发浓缩结晶、趁热过滤.

注:
①硼镁泥的主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.
②硼酸电离平衡常数K=5.8×10-10
③
| 化合物 | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp近似值 | 10-11 | 10-16 | 10-38 | 10-33 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(2)硼酸根离子可表示为B(OH)4-.写出硼酸电离的方程式H3BO3+H2O?B(OH)4-+H+
(3)N滴定法测定硼酸晶体的纯度.研究结果表明,用0.1mol•L-1NaOH溶液直接滴定硼酸溶液,滴定过程如曲线①所示,向硼酸溶液中加入多元醇后再滴定如曲线②所示.请分析,能否用强碱直接滴定硼酸溶液,不能 (填“能”或“不能”),理由是:没有明显的pH突变区域,无法判断终点,会造成较大的误差
(4)向硼镁泥酸浸后的溶液中,加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是ClO-+Mn2++H2O=MnO2↓+Cl-+2H+.
(5)加碱调节至pH为4.7时,杂质离子便可完全沉淀.(离子浓度小于或等于1×l0-5mol•L-1时,即可认为该离子沉淀完全)
(6)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤蒸发浓缩结晶、趁热过滤.

15.下表是 25℃时某些弱酸的电离平衡常数.
下列有关说法不正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
| A. | 若H2C2O4 与等物质的量的 KOH反应后所得溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为:c(K+)>c( HC2O4-)>c( H+)>c( C2O42-)>c( OH-) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O=Cl-+HClO+HCO3- | |
| C. | 常温下,0.1mol/LCH3COOH 溶液加水稀释过程中,表达式c( H+)/c( CH3COOH )的数据变大 | |
| D. | pH相同的 NaClO 和 CH3COOK 溶液,其溶液的物质的量浓度的大小关系是:c( CH3COOK )>c( NaClO ) |
2.下列有关叙述正确的是( )
| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
12.将铜和氧化铁的混和物溶于足量稀盐酸,再向所得溶液滴入2滴 KSCN溶液后出现红色.下列有关说法错误的是( )
| A. | 容器中可能有固体残渣 | B. | 所得溶液中存在Fe2+、Fe3+、Cu2+ | ||
| C. | 原固体中n(Fe2O3)>n(Cu) | D. | 再加入铜后,溶液红色逐渐褪去 |
16. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
下列叙述正确的是cd(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
17.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为19.Y原子的电子层数与最外层电子数的比等于$\frac{1}{3}$,Z原子最外层电子数与内层电子数的比为$\frac{1}{10}$.下列说法正确的是( )
| A. | 非金属性:Y<X<W | |
| B. | 简单气态氢化物的热稳定性:Y<X | |
| C. | 化合物ZW、XY中化学键类型相同 | |
| D. | X、W的最高价氧化物的水化物均为强酸 |
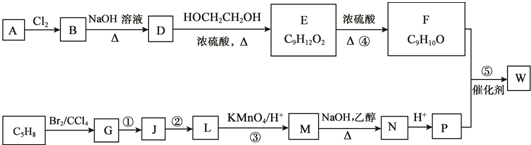
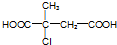 .
. ;D中含氧官能团的名称是羟基;④的反应类型是消去反应.
;D中含氧官能团的名称是羟基;④的反应类型是消去反应.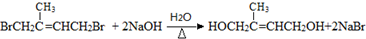 .
. .
.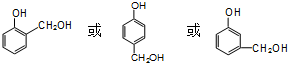 .
.