题目内容
11.化学反应常常伴随能量的变化,以下是 H2与Cl2反应的能量变化示意图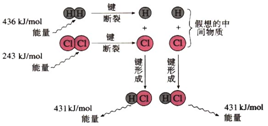
H2(g)+Cl2(g)═2HCl(g)反应的能量变化示意图
下列说法正确的是( )
| A. | 氯化氢分子的电子式: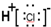 | |
| B. | 该反应是工业制取盐酸的化学反应原理 | |
| C. | 形成1molH-Cl键要吸收431 kJ的能量 | |
| D. | 该反应中反应物总能量小于生成物总能量 |
分析 化学反应中,化学键断裂要吸收能量,形成化学键要放出能量,由键能大小可知H2(g)+Cl2(g)═2HCl(g)的反应热,生成2molHCl,化学键断裂吸收热量:436kJ+243kJ=679kJ,形成化学键放出热量:2×431kJ=862kJ,则反应放热,并根据物质能量越高越活泼分析物质稳定性.
解答 解:A.HCl为共价化合物,电子式不可能有电荷和括号,故A错误;
B.该反应是工业制取盐酸的化学反应原理,故B正确;
C.形成1molH-Cl键要释放收431kJ的能量,故C错误;
D、依据C分析计算,1mol H2(g)和1mol Cl2(g)的总能量高于2mol HCl(g)的总能量,反应放热,该反应中反应物总能量高于生成物总能量,故D错误;
故选B.
点评 本题考查较为综合,题目难度不大,本题注意从键能角度计算反应热的方法,学习中注意相关知识的把握.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
1.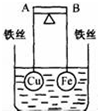 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A 端高B 端低 | |
| B. | 杠杆为导体和绝缘体时,均为A 端低B 端高 | |
| C. | 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 | |
| D. | 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
2.下列有关叙述正确的是( )
| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
16. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
下列叙述正确的是cd(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.
该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)
变化如下表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
3.下列说法不正确的是( )
| A. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| B. | 电解熔融氧化铝、粗硅的制取、生物炼铜、煤焦油中提取苯等过程都涉及化学变化 | |
| C. | 从2016年1月1号开始浙江省汽油标准由“国Ⅳ”提高到“国V”,但这并不意味着汽车不再排放氮氧化物 | |
| D. | 纳米技术、分子设计技术的发展,将使分子晶体管、分子芯片、分子导线、分子计算机等化学器件得到广泛的应用 |
20.膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下.下列说法不正确的是( )
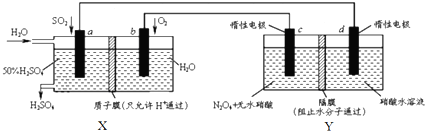

| A. | X是原电池,能够生产硫酸.Y是电解池,能够生产N2O5 | |
| B. | c电极的电极反应方程式为:N2O4+2HNO3-2e-=2N2O5+2H+ | |
| C. | 当电路中通过2mol e-,X、Y中各有1molH+从左边迁移到右边 | |
| D. | 为保证X中硫酸的质量分数不变,则加入的n(so2):n(H2O)=1:7.4 |
1.下列说法不正确的是( )
| A. | 碳原子间都以单链相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 油与脂肪都属于甘油酯 | |
| D. | 葡萄糖与果糖互为同分异构体 |
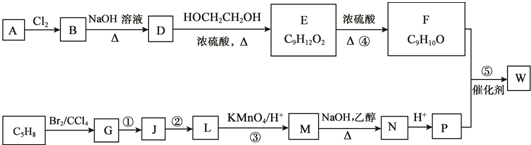
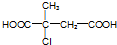 .
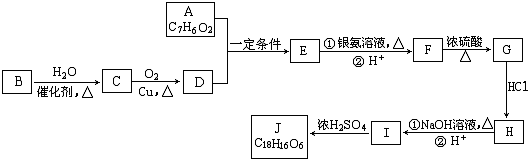
. ;D中含氧官能团的名称是羟基;④的反应类型是消去反应.
;D中含氧官能团的名称是羟基;④的反应类型是消去反应.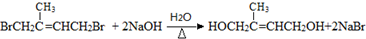 .
. .
.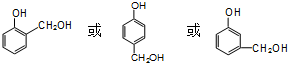 .
.
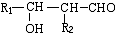
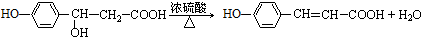 .
.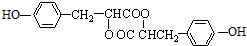 .
.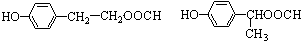 .
.