题目内容
14.图甲是CO2电催化还原为碳氢化合物(CxHy)的工作原理示意图,用某钾盐水溶液做电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,用硫酸为电解质溶液.下列说法中不正确的是( )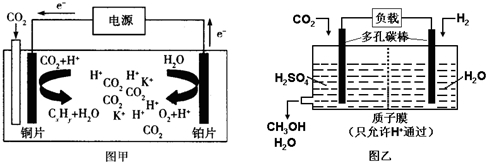
| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O |
分析 甲图中:CO2电催化还原为碳氢化合物,由电子流向可知,则通入CO2的一极为电解池的阴极,另一极为阳极,阳极上氢氧根离子失电子生成氧气,乙图中,燃料电池的正极上氧气发生得电子的还原反应,由此分析解答.
解答 解:A.电解时,电子流向是:阳极→正极→负极→阴极,铜为阴极,所以阳离子K+向铜片电极移动,故A正确;
B.若CxHy为C2H4,则电解的总反应为:2CO2+2H2O$\frac{\underline{\;通电\;}}{\;}$3O2+C2H4,所以生成1 mol C2H4的同时生成3 molO2,故B正确;
C.乙中电解质溶液H2SO4的作用是增强导电性,故C正确;
D.由图可知乙中正极上是二氧化碳发生得电子的还原反应的过程,发生的电极反应为CO2+6e-+6H+═CH3OH+H2O,故D错误;
故选D.
点评 本题考查学生电解池的工作原理知识,侧重于学生的分析能力的考查,注意两极反应式的书写以及氧化还原反应之间的关系,注意规律的总结是关键,难度不大.

练习册系列答案
相关题目
4.常温下a mol/L 稀氨水和b mol/L 稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
| A. | 若a<b,则c(OH-)<c(H+) | B. | 若a>b,则c(NH4+)>c(Cl-) | ||
| C. | 若a>b,则c(OH-)>c(H+) | D. | 若a=b,则c(NH4+)=c(Cl-) |
2.化学方程式是一种重要的化学用语.所写的化学方程式不能用来正确解释化学过程或事实的是( )
| A. | 熔融烧碱时不能使用石英坩埚:SiO2+2NaOH$\stackrel{△}{→}$ Na2SiO3+H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+→I2+O2↑+4H2O | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g) $\stackrel{高温}{→}$Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+→Cl2↑+H2O |
19.NA代表阿伏加德罗常数的数值.下列说法不正确的是( )
| A. | 0.05 mol液态KHSO4中含有0.05 NA个阳离子 | |
| B. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA | |
| C. | 常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA |
6.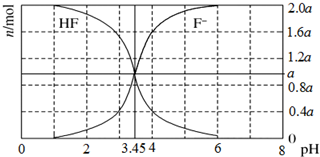 25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
 25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3.45时,溶液中:c(Na+)+c(H+)=c(HF)+c(OH-) | |
| B. | pH=3时,溶液中:c(Na+)>c(F-) | |
| C. | n(F-)=0.6a mol时,溶液中:c(Na+)>c(HF) | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol/L |
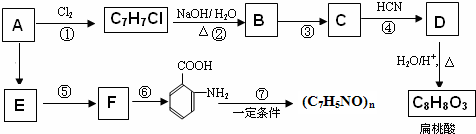
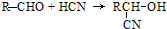
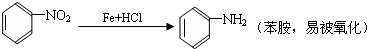
 ;扁桃酸
;扁桃酸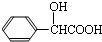 .
. .
. .
.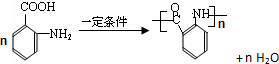 .
.