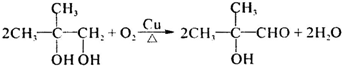
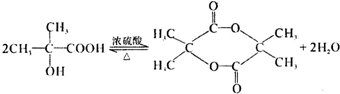
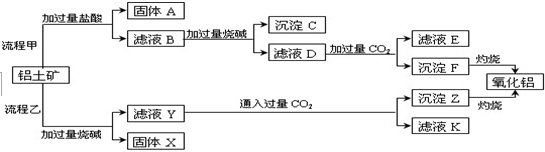
题目内容
3.某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应: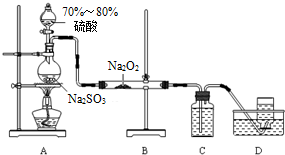
(1)仪器组装完毕,首先需要进行的实验是检查装置的气密性,具体操作和现象为关闭分液漏斗活塞,对烧瓶进行微热,当观察到D中导管口有气泡后,停止加热,D中导管形成一段液柱.
(2)装置A使用的是70%~80%的硫酸,硫酸的浓度不能太低的原因是不利于SO2溢出.
(3)为吸收过量的SO2,C中盛放的试剂为NaOH溶液(或KMnO4溶液).
(4)D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为2Na2O2+2SO2=2Na2SO3+O2(Na2O2+SO2=Na2SO4).
(5)若反应后B中的固体只含有Na2SO3和Na2SO4,测定其中Na2SO3的质量分数的实验方案为:用电子天平称取该固体m1g,溶于水配成溶液,加入足量的氯化钡溶液,用砂芯漏斗过滤,固体用适量乙醇洗涤2~3次,在真空干燥箱中干燥,再用电子天平称量得固体为m2 g;根据实验测得的数据进行计算即可(实验中可选用的试剂:氯化钡溶液、乙醇;除常用仪器外需使用的仪器:砂芯漏斗、真空干燥箱).
由以上实验可得B中固体Na2SO3的质量分数为$\frac{9(142{m}_{2}-{233m}_{1})}{104{m}_{1}}$(用含m1、m2的代数式表示).
分析 (1)仪器组装完毕,首先需要检查装置气密性,装置密闭后加热烧瓶观察D中导气管是否有气泡冒出,停止加热是否产生一段水柱分析判断;
(2)二氧化硫易溶于水,硫酸溶液浓度太低不利于二氧化硫的生成和挥出;
(3)二氧化硫能被氢氧化钠溶液或高锰酸钾溶液吸收;
(4)D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,所以B中发生的反应可能为二氧化硫与过氧化钠反应生成亚硫酸钠和氧气;
(5)若反应后B中的固体只含有Na2SO3和Na2SO4,测定其中Na2SO3的质量分数的实验方案为:用电子天平称取该固体m1g,将样品溶于蒸馏水溶解后加入过量的氯化钡发生反应生成亚硫酸钡沉淀和硫酸钡沉淀,过滤洗涤干燥,用电子天平称量得固体为m2 g,列方程式计算 得到B中固体Na2SO3的质量分数.
解答 解:(1)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应生成气体在最后收集,装置需要生成气体,并验证性质,所以实验装置不能漏气,需要检查装置气密性,把装置密闭关闭分液漏斗活塞,对烧瓶进行微热,当观察到D中导管口有气泡后,停止加热,D中导管形成一段液柱,说明装置气密性完好,
故答案为:检查装置的气密性;关闭分液漏斗活塞,对烧瓶进行微热,当观察到D中导管口有气泡后,停止加热,D中导管形成一段液柱;
(2)装置A使用的是70%~80%的硫酸,硫酸的浓度太低不利于SO2溢出,
故答案为:不利于SO2溢出;
(3)二氧化硫能被氢氧化钠溶液或高锰酸钾溶液吸收,所以C中盛放的试剂为NaOH溶液(或KMnO4溶液),
故答案为:NaOH溶液(或KMnO4溶液);
(4)D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,所以B中发生的反应可能为二氧化硫与过氧化钠反应生成亚硫酸钠和氧气,反应的方程式为2Na2O2+2SO2=2Na2SO3+O2,
故答案为:2Na2O2+2SO2=2Na2SO3+O2(Na2O2+SO2=Na2SO4);
(5)若反应后B中的固体只含有Na2SO3和Na2SO4,测定其中Na2SO3的质量分数的实验方案为:用电子天平称取该固体m1g,溶于水配成溶液,加入足量的氯化钡溶液,用砂芯漏斗过滤,固体用适量乙醇洗涤2~3次,在真空干燥箱中干燥,再用电子天平称量得固体为m2 g;根据实验测得的数据进行计算即可,设Na2SO3质量为xg,则硫酸钠质量为m1g-xg,沉淀m2g为BaSO3和BaSO4,得到:$\frac{xg}{126g/mol}$×217g/mol+$\frac{{m}_{1}-xg}{142g/mol}$×233g/mol=m2,
x=$\frac{9(142{m}_{2}-233{m}_{1})}{104}$g,
固体Na2SO3的质量分数=$\frac{9(142{m}_{2}-{233m}_{1})}{104{m}_{1}}$×100%,
故答案为:溶于水配成溶液,加入足量的氯化钡溶液,用砂芯漏斗过滤,固体用适量乙醇洗涤2~3次,在真空干燥箱中干燥;$\frac{9(142{m}_{2}-{233m}_{1})}{104{m}_{1}}$×100%;
点评 本题考查了物质性质实验探究、装置气密性检查、混合物的含量测定方法和计算应用,注意物质性质的理解,掌握基础是解题关键,题目难度中等.

| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
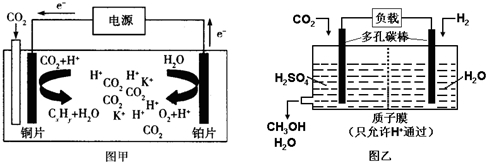
| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O |
| A. | SO2能使溴水褪色,这表现了SO2的漂白性 | |
| B. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| C. | 氨的水溶液能导电,所以氨是强电解质 | |
| D. | 按a、b两种途径制备等量的硝酸镁,消耗的二种酸的物质的量不同 途径a:Mg$→_{△}^{O_{2}}$MgO$\stackrel{稀硝酸}{→}$Mg(NO3)2 途径b:Mg$\stackrel{浓硫酸}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
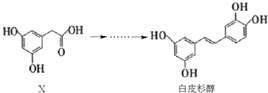
下列说法正确的是( )
| A. | X的分子式为C8H10O4 | |
| B. | 化合物X、白皮杉醇均可与Na2CO3溶液反应并放出气体 | |
| C. | 白皮杉醇与浓溴水反应时,最多可消耗6 mol Br2 | |
| D. | 在一定条件下,白皮杉醇可发生加成、取代、氧化和聚合反应 |
| A. | 该电池又称纽扣电池,是可充电池,适用于大电流连续放电 | |
| B. | 该电池属于碱性电池,放电过程中,锌失去电子生成锌离子,向负极移动 | |
| C. | 该电池在放电过程中,正极的pH变大 | |
| D. | 该电池的负极反应式:Zn-2e-=Zn2+ |
| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
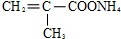 .
.