题目内容
5.实验室用H2O2分解制氧气,若要制取1.25mol的O2,则要消耗H2O2的质量为多少?分析 过氧化氢在二氧化锰催化下分解生成水和氧气,根据反应的化学方程式确定反应中过氧化氢与氧气的质量关系,即可制取氧气的量计算消耗过氧化氢的质量.
解答 解:设要消耗H2O2的质量为xg
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2 1
n(H2O2) 1.25mol
n(H2O2)=2.5mol
m(H2O2)=n(H2O2)×M(H2O2)=2.5mol×34g/mol=85g
答:要消耗H2O2的质量为85g.
点评 本题根据化学方程式的基本计算,正确书写化学方程式是进行计算的基础,规范的书写格式、准确的计算结果则是考试中不失分的关键,本题比较基础.

练习册系列答案
相关题目
13.分子式为 C5H10O2 并能与饱和 NaHCO3 溶液反应放出气体的有机物有 (不含立体异构)( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
20.下列关于CH4、H2、C三种能源物质的研究方向可行的是( )
| A. | 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下使氢成为二次能源 | |
| B. | 寻找优质催化剂,使CO2与H2O反应生成CH4和O2,并放出热量 | |
| C. | 寻找优质催化剂,利用太阳能使大气中的CO2和海底开采的CH4合成合成气(CO、H2) | |
| D. | 将固态碳合成C60,以C60作燃料 |
17.能用键能大小解释的事实是( )
| A. | 硝酸比磷酸易挥发 | |
| B. | 金刚石的熔点比晶体硅高 | |
| C. | 惰性气体一般很难发生化学反应 | |
| D. | 通常情况下单质溴呈液态、碘呈固态 |
14.图甲是CO2电催化还原为碳氢化合物(CxHy)的工作原理示意图,用某钾盐水溶液做电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,用硫酸为电解质溶液.下列说法中不正确的是( )
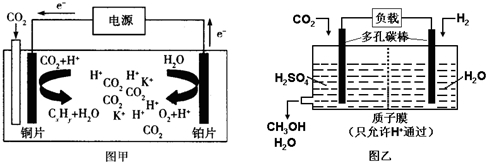

| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O |
15.若阿伏加德罗常数记为NA,则12g 14C(原子核内有6个质子8个中子)含有14C原子数(已知一个14C的质量比一个12C的质量大)( )
| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
 在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如图所示,请回答下列问题;
在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如图所示,请回答下列问题;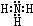 ,B的结构式为
,B的结构式为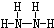 .
.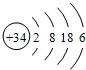 .
.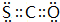 .
.