题目内容
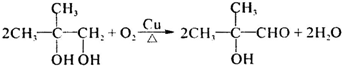
4.我国的市售加碘食用盐中的添加剂为碘酸钾(KIO3).碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.(1)在实验室检验某食用盐是否加碘盐,必须用到的试剂是ab(或abc、abd均可)(填入编号)
a.碘化钾 b.稀硫酸 c.淀粉溶液 d.苯
(2)向上述反应生成的碘溶液中加入四氯化碳,实验现象为溶液分层,下层溶液呈紫红色,上层溶液无色;
(3)Na2SO3可以还原I2,某学生设计利用Na2SO3回收上述实验中的四氯化碳,操作步骤为:①将碘的四氯化碳溶液置于分液漏斗中、②检漏、③分离出下层液体、④振荡、⑤静置、⑥加入适量Na2SO3稀溶液,正确的操作顺序是②①⑥④⑤③(填编号),用到的主要玻璃仪器为分液漏斗,烧杯;
(4)某学生欲利用反应:I2+2S2O32-→2I-+S4O62-测定加碘盐的碘含量,设计实验步骤为:
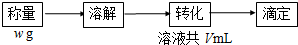
滴定时取20.0mL待测液,消耗2.0×10-3 mol/L的Na2S2O3溶液10.0mL.
①滴定以淀粉溶液为指示剂,显示滴定至恰好完全反应的现象是当滴入最后一滴时,溶液蓝色刚好消失,且30秒内不恢复;
②所测精制盐的碘含量是(以含w的代数式表示)$\frac{127V}{6w}$mg/kg;
(5)日本福岛核泄漏事件引起“抢购盐”风波.按国家标准,加碘盐中碘含量为20~25mg/1kg.为治疗辐射,成年人每日需摄入碘130mg,若这些碘都来自加碘盐,则成年人每日至少需摄入的食盐质量为5.2kg.
分析 (1)加碘食盐中含碘酸根,必须用碘化钾与其在酸性环境中反应产生碘单质;
(2)四氯化碳与水不互溶,且四氯化碳的密度比水大在下层,碘易溶于有机溶济呈紫红色;
(3)用Na2SO3回收上述实验中的四氯化碳,操作步骤为:检漏、装液、振荡、静置、分液;根据萃取实验可知需要用到分液漏斗、烧杯;
(4)①根据反应的离子方程式可知,碘单质被消耗,滴定终点为溶液由蓝色恰好变为无色;
②根据硫代硫酸钠与碘酸钾的关系式计算碘酸钾的物质的量,再根据质量分数公式计算碘的含量;
(5)成年人每日至少需要摄入的食盐应以碘含量最大值来计算.
解答 解:(1)加碘食盐中含碘酸根,必须用碘化钾与其在酸性环境中反应产生碘单质,碘遇淀粉变蓝,碘的四氯化碳溶液呈紫色,故答案为:ab(或abc、abd均可);
(2)四氯化碳与水不互溶要分层,且四氯化碳的密度比水大在下层,碘易溶于有机溶济呈紫红色,则萃取实验现象为溶液分层,下层溶液呈紫红色,上层溶液无色,
故答案为:溶液分层,下层溶液呈紫红色,上层溶液无色;
(3)用Na2SO3回收上述实验中的四氯化碳,操作步骤为:②检漏、①将碘的四氯化碳溶液置于分液漏斗中、⑥加入适量Na2SO3稀溶液、④振荡、⑤静置、③分离出下层液体;根据萃取实验可知需要用到分液漏斗、烧杯,故答案为:②①⑥④⑤③;分液漏斗、烧杯;
(4)①根据反应的离子方程式可知,碘单质被消耗,滴定终点为溶液由蓝色恰好变为无色,故答案为:当滴入最后一滴时,溶液蓝色刚好消失,且30秒内不恢复;
②设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O32-=2I-+S4O62-②,将方程式②×3+①得
IO3-+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0×10-3mol/L×0.01L
x=$\frac{1}{3}$×10-5mol,根据碘原子守恒知,碘元素的质量=$\frac{1}{3}$×10-5mol/L×127g/mol=$\frac{127}{3}$×10-5g,VmL样品中的碘的质量为$\frac{V}{20}$×$\frac{127}{3}$×10-5g,即$\frac{V}{20}$×$\frac{127}{3}$×10-5×103mg,所以碘元素的质量分数为$\frac{V}{20}$×$\frac{127}{3}$×10-5×103mg÷(w×10-3kg)×100%=$\frac{127V}{6w}$;
故答案为:$\frac{127V}{6w}$;
(5)成年人每日至少需要摄入的食盐为130mg÷25mg/kg=5.2kg,故答案为:5.2kg.
点评 考查物质组成与含量的测定、对实验原理理解、氧化还原滴定、阅读获取信息的能力等,难度较大,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案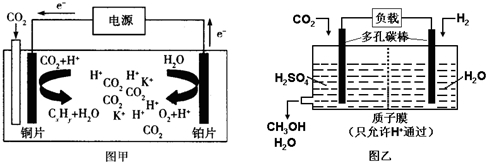
| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O |
| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 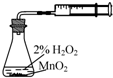 装置可测定化学反应速率 | |
| B. | 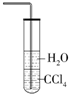 装置可用于吸收氨气,并防止倒吸 | |
| C. |  装置量取8.5 mL的稀硫酸 | |
| D. |  装置可制备氢氧化亚铁并观察其颜色 |
| A. | 甲醛 | B. | 生石灰 | C. | 过氧化氢 | D. | 次氯酸钠 |
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铁棒插入浓硝酸中,无明显现象 | 铁与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 原溶液中可能含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
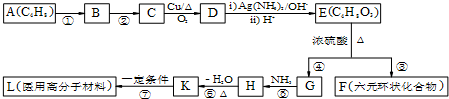
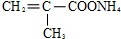 .
.