题目内容
 今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:
今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:(1)C溶液的pH=
(2)B溶液中存在的电离平衡为(用电离平衡方程式表示)
(3)B溶液中溶质CH3COOH电离平衡常数表达式为
(4)A、B、C三种溶液中由水电离出的c(OH-)的大小关系为
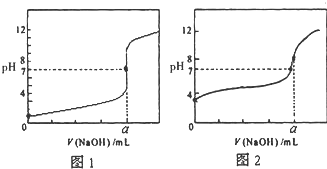
(5)某同学用A溶液分别滴定20.00mLB溶液和20.00mLC溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶溶液滴定C溶液的曲线是
考点:弱电解质在水溶液中的电离平衡,中和滴定
专题:电离平衡与溶液的pH专题
分析:(1)常温下0.01mol/L的NaOH溶液中氢氧根离子的浓度为0.01mol/L,据KW求算溶液的pH;
(2)醋酸溶液中存在醋酸的电离平衡和水的电离平衡;
(3)电离平衡常数表达式为:K=
;
(4)氢离子和氢氧根离子对水的电离都有抑制作用,相同浓度的氢离子和氢氧根离子对水的电离的抑制作用相同;
(5)①据滴定起点的pH确定谁是盐酸谁是醋酸;
②据盐酸与氢氧化钠中和时,C1V1=C2V2求算NaOH溶液的体积.
(2)醋酸溶液中存在醋酸的电离平衡和水的电离平衡;
(3)电离平衡常数表达式为:K=
| [CH3COO-]?[H+] |
| [CH3COOH] |
(4)氢离子和氢氧根离子对水的电离都有抑制作用,相同浓度的氢离子和氢氧根离子对水的电离的抑制作用相同;
(5)①据滴定起点的pH确定谁是盐酸谁是醋酸;
②据盐酸与氢氧化钠中和时,C1V1=C2V2求算NaOH溶液的体积.
解答:
解:(1)常温下0.01mol/L的NaOH溶液中氢氧根离子的浓度为0.01mol/L,则氢离子浓度为1.0×10-12mol/L,所以其pH=12,故答案为:12;
(2)醋酸溶液中存在醋酸的电离平衡和水的电离平衡,其电离方程式为:CH3COO?CH3COO-+H+、H2O?OH-+H+,故答案为:CH3COO?CH3COO-+H+、H2O?OH-+H+;
(3)据醋酸的电离方程式:CH3COO?CH3COO-+H+,其电离平衡常数的表达式为:K=
,故答案为:K=
;
(4)氢离子和氢氧根离子对水的电离都有抑制作用,相同浓度的氢离子和氢氧根离子对水的电离的抑制作用相同,醋酸溶液中氢离子浓度比盐酸中小,盐酸中氢离子浓度与氢氧化钠中氢氧根离子浓度相等,所以对水的电离的抑制作用相同,都强于醋酸,所以,由水电离出来的氢氧根离子浓度由大到小的顺序为:B>A=C,故答案为:B>A=C;
(5)①据滴定开始的pH可知,图1为C溶液(氢氧化钠)滴定A溶液(盐酸),图2为C溶液(氢氧化钠)滴定B溶液(醋酸),故答案为:图2;
②盐酸和氢氧化钠等物质的量反应,所以0.100mol/L的HCl20mL和0.100mol/L的NaOH溶液20mL恰好完全反应,故答案为:20.00.
(2)醋酸溶液中存在醋酸的电离平衡和水的电离平衡,其电离方程式为:CH3COO?CH3COO-+H+、H2O?OH-+H+,故答案为:CH3COO?CH3COO-+H+、H2O?OH-+H+;
(3)据醋酸的电离方程式:CH3COO?CH3COO-+H+,其电离平衡常数的表达式为:K=
| [CH3COO-]?[H+] |
| [CH3COOH] |
| [CH3COO-]?[H+] |
| [CH3COOH] |
(4)氢离子和氢氧根离子对水的电离都有抑制作用,相同浓度的氢离子和氢氧根离子对水的电离的抑制作用相同,醋酸溶液中氢离子浓度比盐酸中小,盐酸中氢离子浓度与氢氧化钠中氢氧根离子浓度相等,所以对水的电离的抑制作用相同,都强于醋酸,所以,由水电离出来的氢氧根离子浓度由大到小的顺序为:B>A=C,故答案为:B>A=C;
(5)①据滴定开始的pH可知,图1为C溶液(氢氧化钠)滴定A溶液(盐酸),图2为C溶液(氢氧化钠)滴定B溶液(醋酸),故答案为:图2;
②盐酸和氢氧化钠等物质的量反应,所以0.100mol/L的HCl20mL和0.100mol/L的NaOH溶液20mL恰好完全反应,故答案为:20.00.
点评:本题考查了相同物质的量浓度的盐酸与醋酸与相同pH的盐酸与醋酸与氢氧化钠反应的不同,题目难度中等.

练习册系列答案
相关题目
将某Mg-Al合金放入足量的盐酸中,生成H2 的体积在标况下是2240ml;同质量的Mg-Al合金放入足量的NaOH溶液中生成H2 的体积在标况下是2016ml,则Mg、Al的质量之比是( )
| A、1:1 | B、6:1 |
| C、1:6 | D、4:27 |
两种气态烃的混合气共0.1mol,在空气中完全燃烧得到0.16molCO2和3.6g水,下列说法正确的是( )
| A、一定含甲烷,不含乙烷 |
| B、一定含乙烷,不含甲烷 |
| C、一定是甲烷和乙烯的混合物 |
| D、一定含甲烷,但不含乙烯 |
A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍.下列说法中正确的是( )
| A、A、C两元素处在元素周期表中的第ⅥA族 |
| B、C、D两种元素的最高价氧化物的水化物相互能够反应生成一种强电解质 |
| C、B、D两元素组成的化合物中阴、阳离子的个数比为1:1 |
| D、B、C、D三种元素的简单离子的半径大小顺序为:C>D>B |
下列能够检验出KI中是否含有Br-的实验是( )
| A、加入足量的新制氯水,溶液颜色变深,则含有Br- |
| B、加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- |
| C、加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br- |
| D、加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |