题目内容
两种气态烃的混合气共0.1mol,在空气中完全燃烧得到0.16molCO2和3.6g水,下列说法正确的是( )
| A、一定含甲烷,不含乙烷 |
| B、一定含乙烷,不含甲烷 |
| C、一定是甲烷和乙烯的混合物 |
| D、一定含甲烷,但不含乙烯 |
考点:有机物的推断
专题:烃及其衍生物的燃烧规律
分析:生成水的物质的量为
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,而碳原子数小于1.6的只有甲烷,则一定含有甲烷,然后根据平均分子式进行判断.
| 3.6g |
| 18g/mol |
解答:
解:生成水的物质的量为
=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,而碳原子数小于1.6的只有甲烷,则一定含有甲烷,则另一种烃分子中一定含4个H原子,且其C原子数大于1.6,故可能是乙烯(C2H4)或丙炔(C3H4)等,一定不是乙烷,综上分析可知,A正确,BCD错误,故选A.
| 3.6g |
| 18g/mol |
点评:本题考查混合烃组成的判断,难度中等,利用有机物完全燃烧生成的CO2和H2O的物质的量计算平均分子式,再根据平均分子式进行判断.

练习册系列答案
相关题目
下列化学用语描述中正确的是( )
A、含18个中子的氯原子的核素符号:
| ||
B、比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | ||
| C、HCO3-的电离方程式为:HCO3-+H2O?CO32-+H3O+ | ||
| D、次氯酸的结构式:H×Cl-O |
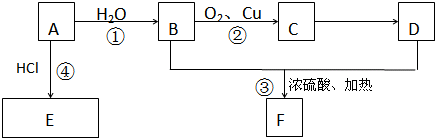
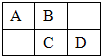 A、B、C、D为短周期元素,在周期表中所处的位置如图所示.A、D两元素的原子核外电子数之和等于B、C两元素的原子核外电子数之和.C元素的质子数是B元素的质子数的2倍.
A、B、C、D为短周期元素,在周期表中所处的位置如图所示.A、D两元素的原子核外电子数之和等于B、C两元素的原子核外电子数之和.C元素的质子数是B元素的质子数的2倍.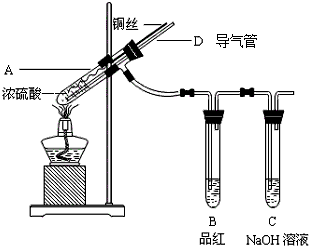 某同学为了探究铜与浓硫酸的反应,进行了如下实验.
某同学为了探究铜与浓硫酸的反应,进行了如下实验.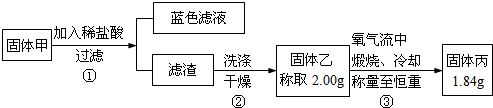


 某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下:
某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下: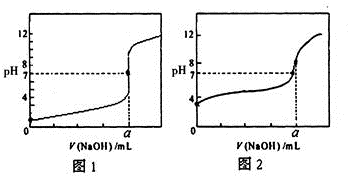 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.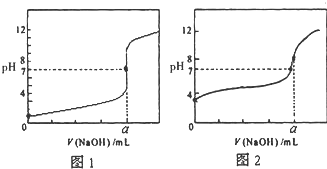 今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:
今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题: