题目内容
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba ( NO3 )2中的几种均匀混合而成,取样品进行如下实验(部分产物略去):
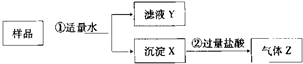
(1)实验①中分离操作称为 ,所用到的玻璃仪器名称
(2)在实验②中观察到的现象是“沉淀部分溶解”.为进一步确定X的组成,向实验②后的溶液中滴加过量的氨水,有沉淀生成,写出生成沉淀的离子反应方程式为 ,则沉淀X含有的物质的化学式为 .
(3)取滤液Y,测得其pH>7,向其中滴入硫酸钠溶液,未观察到任何现象,则滤液Y中一定含有的含氧酸根离子是(用离子符号表示) ,由此推测“将过量的气体Z通入滤液Y中”的实验现象是 .
(4)上述推断可见,实验①中能反应的物质之间的物质的量的比例关系为 .

(1)实验①中分离操作称为
(2)在实验②中观察到的现象是“沉淀部分溶解”.为进一步确定X的组成,向实验②后的溶液中滴加过量的氨水,有沉淀生成,写出生成沉淀的离子反应方程式为
(3)取滤液Y,测得其pH>7,向其中滴入硫酸钠溶液,未观察到任何现象,则滤液Y中一定含有的含氧酸根离子是(用离子符号表示)
(4)上述推断可见,实验①中能反应的物质之间的物质的量的比例关系为
考点:探究物质的组成或测量物质的含量
专题:
分析:样品溶于水生成沉淀和滤液,沉淀X可能是CaCO3或K2SO4和Ba(NO3)2,混合生成的硫酸钡沉淀;或NaOH和AlCl3的混合物生成的沉淀Al(OH)3;又因为沉淀加入过量盐酸生成气体Z,说明溶于水形成的沉淀中含有CaCO3,据此分析.
解答:
解:样品溶于水生成沉淀和滤液,沉淀X可能是CaCO3或K2SO4和Ba(NO3)2,混合生成的硫酸钡沉淀;或NaOH和AlCl3的混合物生成的沉淀Al(OH)3;又因为沉淀加入过量盐酸生成气体Z,说明溶于水形成的沉淀中含有CaCO3;
(1)根据实验①后为沉淀X和滤液y,所以分离操作称为过滤,所用到的玻璃仪器名称玻璃棒、烧杯、漏斗,故答案为:过滤;玻璃棒、烧杯、漏斗;
(2)沉淀部分溶解说明有硫酸钡,向实验②后的溶液中滴加过量的氨水,有沉淀生成,说明原来有AlCl3,即X中有Al(OH)3,则氨水与铝离子的反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;所以X中含有CaCO3、BaSO4、Al(OH)3;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;CaCO3、BaSO4、Al(OH)3;
(3)取滤液Y,测得其pH>7,说明含氢氧化钠,滤液Y中含有的含氧根离子可能是AlO2-、NO3-;根据(2)判断X中含有CaCO3、BaSO4、Al(OH)3;
加过量盐酸产生气体Z,则Z为二氧化碳,因为氢氧化铝只与强酸强碱反应,所以将过量的气体Z通入滤液Y中,二氧化碳与AlO2-反应只生成氢氧化铝沉淀,
故答案为:AlO2-、NO3-;有白色沉淀生成并不溶解;
(4)取滤液Y,分析可知其中含有AlO2-;根据Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,所以
<
<
;向其中滴入硫酸钠溶液,未观察到任何现象,说明钡离子完全反应,即硫酸钾过了,所以
<1;
故答案为:
<
<
;
<1.
(1)根据实验①后为沉淀X和滤液y,所以分离操作称为过滤,所用到的玻璃仪器名称玻璃棒、烧杯、漏斗,故答案为:过滤;玻璃棒、烧杯、漏斗;
(2)沉淀部分溶解说明有硫酸钡,向实验②后的溶液中滴加过量的氨水,有沉淀生成,说明原来有AlCl3,即X中有Al(OH)3,则氨水与铝离子的反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;所以X中含有CaCO3、BaSO4、Al(OH)3;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;CaCO3、BaSO4、Al(OH)3;
(3)取滤液Y,测得其pH>7,说明含氢氧化钠,滤液Y中含有的含氧根离子可能是AlO2-、NO3-;根据(2)判断X中含有CaCO3、BaSO4、Al(OH)3;
加过量盐酸产生气体Z,则Z为二氧化碳,因为氢氧化铝只与强酸强碱反应,所以将过量的气体Z通入滤液Y中,二氧化碳与AlO2-反应只生成氢氧化铝沉淀,
故答案为:AlO2-、NO3-;有白色沉淀生成并不溶解;
(4)取滤液Y,分析可知其中含有AlO2-;根据Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,所以
| 1 |
| 4 |
| n(AlCl 3) |
| n(NaOH) |
| 1 |
| 3 |
| n(Ba(NO 3) 2) |
| n(K 2SO 4) |
故答案为:
| 1 |
| 4 |
| n(AlCl 3) |
| n(NaOH) |
| 1 |
| 3 |
| n(Ba(NO 3) 2) |
| n(K 2SO 4) |
点评:本题考查了物质检验的方法和物质性质的应用,主要是根据反应现象和物质性质的分析判断,注意氯化铝在过量氢氧化钠溶液中生成的偏铝酸钠再加入过量盐酸又重新生成氯化铝溶液的判断,题目难度中等.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
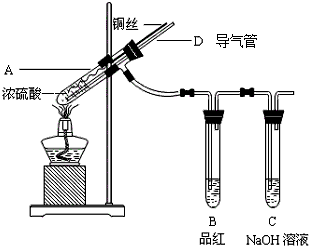 某同学为了探究铜与浓硫酸的反应,进行了如下实验.
某同学为了探究铜与浓硫酸的反应,进行了如下实验.


 某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下:
某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下: 今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:
今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题: