题目内容
A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大.已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.请回答下列问题:
(1)写出D的名称 ,E的最高价氧化物的水化物的分子式 .
(2)画出B元素的原子结构示意图 .
(3)若构成F元素的一种核素的中子数为18,写出该核素的表示符号 .
(4)A与C、C与F元素最高价氧化物的水化物反应的离子方程式依次为: 、 .
(1)写出D的名称
(2)画出B元素的原子结构示意图
(3)若构成F元素的一种核素的中子数为18,写出该核素的表示符号
(4)A与C、C与F元素最高价氧化物的水化物反应的离子方程式依次为:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种元素,它们的核电荷数均小于18,原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E的原子序数大于D,E原子有3个电子层,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,据此解答.
解答:
解:A、B、C、D、E、F六种元素,它们的核电荷数均小于18,原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E的原子序数大于D,E原子有3个电子层,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,
(1)由上面的分析可知,D为硅元素,E为磷元素,它的最高价氧化物的水化物的分子式为H3PO4,
故答案为:硅;H3PO4;
(2)B为镁元素,它的原子结构示意图为 ,
,
故答案为: ;
;
(3)若构成氯元素的一种核素的中子数为18,则该核素的表示符号为3517Cl,
故答案为:3517Cl;
(4)氢氧化钠与氢氧化铝、氢氧化铝与高氯酸反应的离子方程式依次为OH-+Al(OH)3═AlO2-+2H2O、3H++Al(OH)3═Al3++3H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O、3H++Al(OH)3═Al3++3H2O;
(1)由上面的分析可知,D为硅元素,E为磷元素,它的最高价氧化物的水化物的分子式为H3PO4,
故答案为:硅;H3PO4;
(2)B为镁元素,它的原子结构示意图为
 ,
,故答案为:
 ;
;(3)若构成氯元素的一种核素的中子数为18,则该核素的表示符号为3517Cl,
故答案为:3517Cl;
(4)氢氧化钠与氢氧化铝、氢氧化铝与高氯酸反应的离子方程式依次为OH-+Al(OH)3═AlO2-+2H2O、3H++Al(OH)3═Al3++3H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O、3H++Al(OH)3═Al3++3H2O;
点评:本题主要考查了原子结构示意图、原子结构的表示方法、离子反应,元素推断是解题的关键,难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
氯水的成分中含Cl2、H2O、HCl、HClO,在与其它物质反应时,有时以Cl2为主,有时以HCl、HClO为主,然后Cl2+H2O?HCl+HClO平衡发生移动.则新制氯水与下列溶液的反应中以Cl2为主的是( )
①NaBr ②NaOH ③KI ④AgNO3.
①NaBr ②NaOH ③KI ④AgNO3.
| A、①④ | B、①②③ | C、①② | D、①③ |
下列说法不正确的是( )
| A、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| B、用甘氨酸和丙氨酸缩合最多可形成4种二肽 |
| C、分子式为C4H6O2,既能与NaOH溶液反应又能与溴的四氯化碳溶液反应的有机物有4种 |
D、乳酸薄荷醇酯(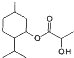 )能发生水解、氧化、消去反应 )能发生水解、氧化、消去反应 |
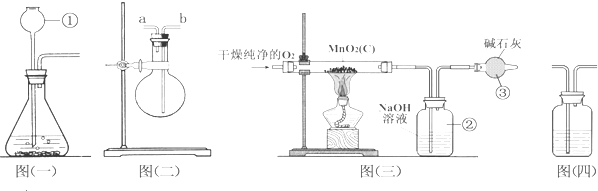
 某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下:
某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下: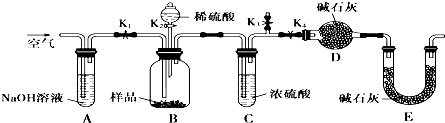
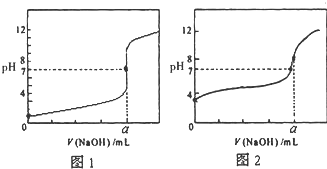 今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:
今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题: