题目内容
几种短周期元素的原子半径及某些化合价见下表:
分析上表中有关数据,并结合已学过的知识,回答以下问题(请用元素符号表示):
(1)用电子式表示J和E的形成过程:
(2)A、H、J对应的离子半径由大到小的顺序是:
(3)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为 .
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +6、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
(1)用电子式表示J和E的形成过程:
(2)A、H、J对应的离子半径由大到小的顺序是:
(3)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素,A、E有-1价,B有-2价,且A的原子半径与B相差不大,则A、E处于ⅦA族,B处于ⅥA族,A原子半径小于E,可推知A为F、E为Cl,B为O;D有-4、+4价,处于ⅣA族,原子半径与O原子相差不大,可推知D为C元素;G元素有-3、+5价,处于ⅤA族,原子半径大于C原子,应处于第三周期,则G为P元素;H、I、J的化合价分别为+3、+2、+1,分别处于ⅢA族、ⅡA族、ⅠA族,原子半径依次增大,且都大于P原子半径,应处于第三周期,可推知H为Al、I为Mg、J为Na,即A为F,B为O,D为C、E为Cl,G为P;H为Al,I为Be,J为Na,据此解答.
解答:
解:短周期元素,A、E有-1价,B有-2价,且A的原子半径与B相差不大,则A、E处于ⅦA族,B处于ⅥA族,A原子半径小于E,可推知A为F、E为Cl,B为O;D有-4、+4价,处于ⅣA族,原子半径与O原子相差不大,可推知D为C元素;G元素有-3、+5价,处于ⅤA族,原子半径大于C原子,应处于第三周期,则G为P元素;H、I、J的化合价分别为+3、+2、+1,分别处于ⅢA族、ⅡA族、ⅠA族,原子半径依次增大,且都大于P原子半径,应处于第三周期,可推知H为Al、I为Mg、J为Na,即A为F,B为O,D为C、E为Cl,G为P;H为Al,I为Be,J为Na,
(1)用电子式表示NaCl的形成过程为 ,故答案为:
,故答案为: ;
;
(2)根据电子层数相同,核电荷数越多,离子半径越小可知,F、Al、Na对应的离子半径由大到小的顺序是F->Na+>Al3+,
故答案为:F->Na+>Al3+;
(3)B与H所形成的化合物为氧化铝,J的最高价氧化物的水化物X为氢氧化钠,它们的溶液发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
(1)用电子式表示NaCl的形成过程为
 ,故答案为:
,故答案为: ;
;(2)根据电子层数相同,核电荷数越多,离子半径越小可知,F、Al、Na对应的离子半径由大到小的顺序是F->Na+>Al3+,
故答案为:F->Na+>Al3+;
(3)B与H所形成的化合物为氧化铝,J的最高价氧化物的水化物X为氢氧化钠,它们的溶液发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题考查性质结构位置关系应用,难度中等,根据半径与化合价推断元素是解题关键.

练习册系列答案
相关题目
 某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下:
某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下: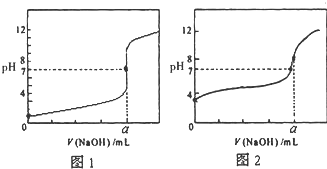 今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:
今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题: