题目内容
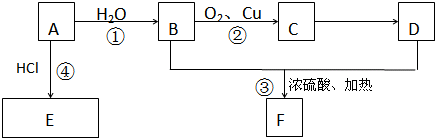
已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
;D与C同一主族,E-比C2-多一个电子层.试回答:
(1)D与E两元素相比较,非金属性较强的是 (填元素名称),请你自选试剂设计实验验证该结论(说明试剂、简单操作、实验现象) ;
(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)B和C形成的一种化合物是参与大气循环的气体,写出它的电子式 ;
(4)A和C也可形成一种18电子分子,写出该分子的结构式 .
| 3 |
| 4 |
(1)D与E两元素相比较,非金属性较强的是
(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(3)B和C形成的一种化合物是参与大气循环的气体,写出它的电子式
(4)A和C也可形成一种18电子分子,写出该分子的结构式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大,A和B可形成常见化合物BA4,一个BA4分子中电子总数为10,且A的原子序数小于B,则A是H元素、B是C元素;
C原子的最外层电子数是核外电子总数的
,若有两个电子层,则C是O元素,符合题意,若有3层电子,则求出最外层电子数为10,不符合题意,即C为O元素;
D与C同一主族,且为短周期元素,所以D是S元素;
E-比C2-多一个电子层,则E为Cl元素;据此解答各小题即可.
C原子的最外层电子数是核外电子总数的
| 3 |
| 4 |
D与C同一主族,且为短周期元素,所以D是S元素;
E-比C2-多一个电子层,则E为Cl元素;据此解答各小题即可.
解答:
解:A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大,A和B可形成常见化合物BA4,一个BA4分子中电子总数为10,且A的原子序数小于B,则A是H元素、B是C元素;
C原子的最外层电子数是核外电子总数的
,若有两个电子层,则C是O元素,符合题意,若有3层电子,则求出最外层电子数为10,不符合题意,即C为O元素;
D与C同一主族,且为短周期元素,所以D是S元素;
E-比C2-多一个电子层,则E为Cl元素
综上所述:A为氢,B为碳,C为氧,D为硫,E为氯,
(1)同一周期元素中,元素的非金属性随着原子序数的增大而增强,D与E两元素相比较,非金属性较强的是Cl,氯气能氧化硫化氢生成淡黄色的硫单质,反应方程式为Cl2+H2S=2HCl+S,故答案为:Cl;把氯气通入硫化氢溶液和,生成淡黄色的固体,Cl2+H2S=2HCl+S;
(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价的双原子阴离子且甲有18个电子,乙有10个电子,则甲是HS-、乙是OH-,则甲与乙反应为S 2-和H2O,该反应的离子方程式为 HS-+OH-=S 2-+H2O,故答案为:HS-+OH-=S 2-+H2O;
(3)B和C形成的一种化合物是参与大气循环的气体,则该气体是CO2,CO2的电子式为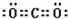 ,故答案为:
,故答案为: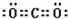 ;
;
(4)A和C也可形成一种18电子分子,该分子为H2O2,该分子的结构式为H-O-O-H,故答案为:H-O-O-H.
C原子的最外层电子数是核外电子总数的
| 3 |
| 4 |
D与C同一主族,且为短周期元素,所以D是S元素;
E-比C2-多一个电子层,则E为Cl元素
综上所述:A为氢,B为碳,C为氧,D为硫,E为氯,
(1)同一周期元素中,元素的非金属性随着原子序数的增大而增强,D与E两元素相比较,非金属性较强的是Cl,氯气能氧化硫化氢生成淡黄色的硫单质,反应方程式为Cl2+H2S=2HCl+S,故答案为:Cl;把氯气通入硫化氢溶液和,生成淡黄色的固体,Cl2+H2S=2HCl+S;
(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价的双原子阴离子且甲有18个电子,乙有10个电子,则甲是HS-、乙是OH-,则甲与乙反应为S 2-和H2O,该反应的离子方程式为 HS-+OH-=S 2-+H2O,故答案为:HS-+OH-=S 2-+H2O;
(3)B和C形成的一种化合物是参与大气循环的气体,则该气体是CO2,CO2的电子式为
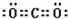 ,故答案为:
,故答案为: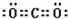 ;
;(4)A和C也可形成一种18电子分子,该分子为H2O2,该分子的结构式为H-O-O-H,故答案为:H-O-O-H.
点评:本题考查了元素位置结构性质的相互关系及应用,涉及电子式和结构式的书写、元素非金属性强弱的判断等知识点,知道常见含有10电子、18电子的微粒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


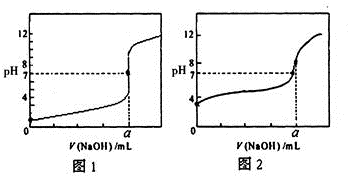 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.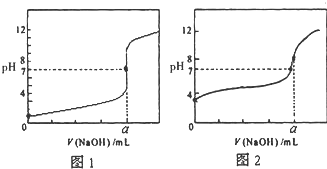 今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:
今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题: