题目内容
下列说法错误的是( )
| A、硝酸的摩尔质量和6.02×1023个硝酸分子的质量(以克为单位)在数值上相等 |
| B、6.02×10个氮气分子和6.02×1023个氢气分子的质量比等于14:1 |
| C、32g氧气所含的原子数目约为2×6.02×1023 |
| D、通常情况下,近似值6.02×1023就是我们所说的阿伏伽德罗常数 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、摩尔质量在数值上和相对分子质量相等,与6.02×1023个分子质量相等;
B.根据n=
=
计算;
C.根据n=
=
结合分子构成计算;
D、阿伏伽德罗常数有单位,数值没有单位.
B.根据n=
| m |
| M |
| N |
| NA |
C.根据n=
| m |
| M |
| N |
| NA |
D、阿伏伽德罗常数有单位,数值没有单位.
解答:
解:A.摩尔质量在数值上和相对分子质量相等,等于1mol物质的质量,与6.02×1023个分子质量相等,故A正确;
B.由n=
=
可知,分子的质量比等于摩尔质量之比28:2=14:1,故B正确;
C.n=
=1mol,氧气为双原子分子,原子数目为2×6.02×1023,故C正确;
D、阿伏加德罗常数是有单位的,通常情况下,近似值6.02×1023/mol就是我们所说的阿状加德罗常数,故D错误;
故选D.
B.由n=
| m |
| M |
| N |
| NA |
C.n=
| 32g |
| 32g/mol |
D、阿伏加德罗常数是有单位的,通常情况下,近似值6.02×1023/mol就是我们所说的阿状加德罗常数,故D错误;
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
把铁和铜加入到氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余则( )
| A、溶液中有Fe2+、Cu2+ |
| B、剩下的固体是Fe和Cu |
| C、溶液中有Fe3+、Fe2+ |
| D、剩下的固体是Fe,无Cu |
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、1 mol NH3与1mol OH-所含的质子数均为10NA |
| B、常温下,pH=13的NaOH溶液中含OH-数目为NA |
| C、常温下,14g乙烯中含碳原子数为NA |
| D、标准状况下,22.4L CHCl3中含C-H键数目为NA |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,2克氢气所含原子数目为NA |
| B、4.6克钠与水反应时失去的电子数目为0.2NA |
| C、在标准状况下,22.4LNH3所含的质子数目为NA |
| D、1 L0.5mol?L-1Na2SO4溶液中所含有的Na+离子数目为2NA |
下列各组物质的性质比较中不正确的是( )
| A、酸性:HClO4>H2SO4>H3 PO4 |
| B、热稳定性:SiH4>PH3>H2 S |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、氧化性:F2>C12>Br2 |
下列反应的离子方程式不正确的是( )
| A、醋酸加入氨水:CH3COOH+NH3?H2O=CH3COO-+NH4++H2O |
| B、铜片插入硝酸银溶液:Cu+Ag+=Cu 2++Ag |
| C、碳酸钙加入醋酸:CO32-+2 CH3COOH=CO2↑+2 CH3COO-+H2O |
| D、澄清的石灰水跟盐酸反应:H++OH-=H2O |
室温下,将一元酸HA溶液和NaOH溶液等体积混合,实验数据如表:下列说法正确的是( )
| 实验编号 | 起始浓度c(HA) | 起始浓度c(NaOH) | 反应后溶液的pH |
| ① | 0.2mol?L-1 | 0.2mol?L-1 | 9 |
| A、HA是一元强酸 |
| B、反应后溶液中c(A-)>c(Na+) |
C、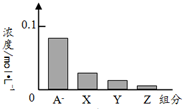 若用如图来表示反应后各微粒的关系,则图中X 表示OH-,Y表示HA,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)>c(Na+) |
将0.2mol/L的FeBr2与0.1mol/L FeI2溶液等体积混合后,慢慢通入一定体积的氯气,可能发生的离子反应方程式为( )
| A、Cl2+2Fe2+→2Cl-+2Fe3+ |
| B、2Cl2+2Fe2++2I-=2Fe3++4Cl-+I2 |
| C、3Cl2+2Fe2++4Br-→2Fe3++6Cl-+2Br2 |
| D、6Cl2+6Fe2++4I-+2Br-=6Fe3++12Cl-+2I2+Br2 |