题目内容
下列表示对应化学反应的离子方程式正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、向40 mL 8 mol/L的稀硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应后的溶液为中性,则硫酸氢钠与氢氧化钡的物质的量按照2:1反应;
B.计算出硝酸的物质的量和铁的物质的量,依据硝酸与铁的反应的定量关系,写出离子方程式;
C.根据电子守恒判断,离子方程式两边得失电子不相等;
D.氯气过量,碘离子和亚铁离子都参与反应,碘离子的系数错误.
B.计算出硝酸的物质的量和铁的物质的量,依据硝酸与铁的反应的定量关系,写出离子方程式;
C.根据电子守恒判断,离子方程式两边得失电子不相等;
D.氯气过量,碘离子和亚铁离子都参与反应,碘离子的系数错误.
解答:
解:A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O,溶液中氢离子与氢氧根离子物质的量相等,正确的离子方程式为:2H++2SO42-+Ba2++2OH-=2BaSO4↓+2H2O,故A正确;
B.硝酸的物质的量为:8mol/L×0.04L=0.32mol,铁的物质的量为:
=0.1mol,硝酸为稀硝酸,
发生反应为:Fe+4H++NO3-=Fe3++NO↑+2H2O,
0.08mol 0.32mol
铁粉剩余0.02mol,剩余的铁粉与生成的三价铁离子反应,生成二价铁离子,所以,正确的离子反应方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故B错误;
C.用稀硝酸洗涤试管内壁的银镜,银与稀硝酸反应生成硝酸银、一氧化氮气体和水,正确的离子方程式为:3Ag+4H++NO3-=3Ag++NO↑+2H2O,故C错误;
D.碘化亚铁溶液中通入过量Cl2,亚铁离子和碘离子都被氯气氧化,正确的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,故D错误;
故选A.
B.硝酸的物质的量为:8mol/L×0.04L=0.32mol,铁的物质的量为:
| 5.6g |
| 56g/mol |
发生反应为:Fe+4H++NO3-=Fe3++NO↑+2H2O,
0.08mol 0.32mol
铁粉剩余0.02mol,剩余的铁粉与生成的三价铁离子反应,生成二价铁离子,所以,正确的离子反应方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故B错误;
C.用稀硝酸洗涤试管内壁的银镜,银与稀硝酸反应生成硝酸银、一氧化氮气体和水,正确的离子方程式为:3Ag+4H++NO3-=3Ag++NO↑+2H2O,故C错误;
D.碘化亚铁溶液中通入过量Cl2,亚铁离子和碘离子都被氯气氧化,正确的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,故D错误;
故选A.
点评:本题考查离子反应方程式的书写,题目难度中等,熟悉发生的化学反应是解答本题的关键,在书写电离方程式时,须注意电子守恒、电荷守恒及与量有关的离子反应的书写方法来解答.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
下列说法正确的是( )
| A、向饱和的碳酸钠溶液中通入CO2气体,没有明显实验现象 |
| B、向久置于空气中的FeSO4溶液中滴加NaOH溶液,产生大量白色沉淀 |
| C、在空气中用酒精灯加热铝箔,铝箔熔化,失去光泽,但熔化的铝并不滴落 |
| D、向某溶液中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明该溶液中一定含有CO32- |
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、1 mol NH3与1mol OH-所含的质子数均为10NA |
| B、常温下,pH=13的NaOH溶液中含OH-数目为NA |
| C、常温下,14g乙烯中含碳原子数为NA |
| D、标准状况下,22.4L CHCl3中含C-H键数目为NA |
下列各组物质的性质比较中不正确的是( )
| A、酸性:HClO4>H2SO4>H3 PO4 |
| B、热稳定性:SiH4>PH3>H2 S |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、氧化性:F2>C12>Br2 |
下列反应的离子方程式不正确的是( )
| A、醋酸加入氨水:CH3COOH+NH3?H2O=CH3COO-+NH4++H2O |
| B、铜片插入硝酸银溶液:Cu+Ag+=Cu 2++Ag |
| C、碳酸钙加入醋酸:CO32-+2 CH3COOH=CO2↑+2 CH3COO-+H2O |
| D、澄清的石灰水跟盐酸反应:H++OH-=H2O |
下列离子方程式中,正确的是( )
| A、稀硫酸与氢氧化钡溶液反应:Ba2++SO42-?BaSO4↓ |
| B、稀盐酸滴在铜片上:Cu+2H+?Cu2++H2↑ |
| C、小苏打与氢氧化钠溶液混合:HCO3-+OH-?CO2↑+H2O |
| D、氧化铜与稀硫酸混合:CuO+2H+?Cu2++H2O |
室温下,将一元酸HA溶液和NaOH溶液等体积混合,实验数据如表:下列说法正确的是( )
| 实验编号 | 起始浓度c(HA) | 起始浓度c(NaOH) | 反应后溶液的pH |
| ① | 0.2mol?L-1 | 0.2mol?L-1 | 9 |
| A、HA是一元强酸 |
| B、反应后溶液中c(A-)>c(Na+) |
C、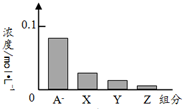 若用如图来表示反应后各微粒的关系,则图中X 表示OH-,Y表示HA,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)>c(Na+) |
某无色溶液用惰性电极电解时,有如下两个实验现象:(1)阳极上有无色气体产生;(2)阴极上有白色沉淀生成;此溶液中可能大量共存的离子是( )
| A、Na+、Ba2+、NO3-、Cl- |
| B、NO3-、Mg2+、Na+、SO42- |
| C、CO32-、K+、Cl-、Na+ |
| D、Fe2+、NO3-、SO42-、Na+ |
试管中盛有白色晶体,检验它是不是铵盐的方法中不可行的是( )
| A、加热,将湿润的红色石蕊试纸放在管口 |
| B、加氢氧化钠溶液,加热,将湿润的酚酞试纸放在管口 |
| C、加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在管口 |
| D、加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 |