题目内容
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库.
(1)3He是高效能原料,其原子核内的中子数为
(2)Na的原子结构示意图为 ,Na在氧气中完全燃烧所得产物的电子式为
(3)MgCl2在工业上应用广泛,可由MgO制备.
①MgO的熔点比BaO的熔点 (填“高”或“低”.)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为 ;SiO2的晶体类型为 .
③MgO与碳粉和氯气在一定条件下反应可制备MgCl2.若尾气可用足量NaOH溶液完全吸收,则生成的盐为 (写化学式).
(4)月壤中含有丰富的3He,从月壤中提炼1kg 3He,同时可得6000kg H2和700kg N2,若以得到H2和N2为原料经一系列反应最多可生产碳酸氢铵 kg.
(1)3He是高效能原料,其原子核内的中子数为
(2)Na的原子结构示意图为
(3)MgCl2在工业上应用广泛,可由MgO制备.
①MgO的熔点比BaO的熔点
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为
③MgO与碳粉和氯气在一定条件下反应可制备MgCl2.若尾气可用足量NaOH溶液完全吸收,则生成的盐为
(4)月壤中含有丰富的3He,从月壤中提炼1kg 3He,同时可得6000kg H2和700kg N2,若以得到H2和N2为原料经一系列反应最多可生产碳酸氢铵
考点:镁、铝的重要化合物,质量数与质子数、中子数之间的相互关系,钠的化学性质
专题:原子组成与结构专题,几种重要的金属及其化合物
分析:(1)依据质子数+中子数=质量数计算;
(2)钠原子时11号元素,依据核外电子排布规律写出原子结构示意图,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成;
(3)①依据氧化镁和氧化钡是离子化合物,结合离子键的强弱分析判断熔点高低;
②氧化镁是碱性氧化物,二氧化硅酸式酸性氧化物,可以利用二氧化硅溶于氢氧化钠溶液除去,二氧化硅是硅原子和氧原子构成属于原子晶体;
③MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物;
(4)氢气和氮气反应生成氨气,依据化学方程式定量关系分析可知氢气过量,依据氮气全部反应,结合氮原子守恒计算碳酸氢铵质量;
(2)钠原子时11号元素,依据核外电子排布规律写出原子结构示意图,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成;
(3)①依据氧化镁和氧化钡是离子化合物,结合离子键的强弱分析判断熔点高低;
②氧化镁是碱性氧化物,二氧化硅酸式酸性氧化物,可以利用二氧化硅溶于氢氧化钠溶液除去,二氧化硅是硅原子和氧原子构成属于原子晶体;
③MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物;
(4)氢气和氮气反应生成氨气,依据化学方程式定量关系分析可知氢气过量,依据氮气全部反应,结合氮原子守恒计算碳酸氢铵质量;
解答:
解:(1)3He是高效能原料,其原子核内的中子数=质量数-质子数=3-2=1;
故答案为:1;
(2)钠原子时11号元素,依据核外电子排布规律写出原子结构示意图 ,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成,电子式为:
,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成,电子式为: ;
;
故答案为: ,
, ;
;
(3)①氧化镁和氧化钡是离子化合物,钡离子半径大于镁离子半径,氧化镁形成的金属键强,熔点高;
故答案为:高;
②氧化镁是碱性氧化物,二氧化硅酸式酸性氧化物,可以利用二氧化硅溶于氢氧化钠溶液除去,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;二氧化硅是硅原子和氧原子构成,每个硅原子和四个氧原子形成共价键,每个氧原子和两个硅原子形成共价键,属于原子晶体;
故答案为:SiO2+2OH-=SiO32-+H2O;原子晶体;
③MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,产物为NaCl,NaClO,Na2CO3 ;
故答案为:NaCl,NaClO,Na2CO3 ;
(4)得6000kg H2和700kg N2,依据化学方程式N2+3H2=2NH3,若以得到H2和N2为原料想可知氢气过量,依据氮气中氮元素守恒计算,经一系列反应最多可生产碳酸氢铵的质量=
×2×79g/mol=3950kg;
故答案为:3950.
故答案为:1;
(2)钠原子时11号元素,依据核外电子排布规律写出原子结构示意图
 ,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成,电子式为:
,钠在氧气中燃烧生成过氧化钠,过氧化钠是过氧根离子和钠离子构成,电子式为: ;
;故答案为:
 ,
, ;
;(3)①氧化镁和氧化钡是离子化合物,钡离子半径大于镁离子半径,氧化镁形成的金属键强,熔点高;
故答案为:高;
②氧化镁是碱性氧化物,二氧化硅酸式酸性氧化物,可以利用二氧化硅溶于氢氧化钠溶液除去,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;二氧化硅是硅原子和氧原子构成,每个硅原子和四个氧原子形成共价键,每个氧原子和两个硅原子形成共价键,属于原子晶体;
故答案为:SiO2+2OH-=SiO32-+H2O;原子晶体;
③MgO与碳粉和氯气在一定条件下反应可制备MgCl2,反应产物为二氧化碳,若尾气可用足量NaOH溶液完全吸收是氯气、二氧化碳和氢氧化钠反应的产物,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,Cl2+2NaOH=NaCl+NaClO+H2O,产物为NaCl,NaClO,Na2CO3 ;
故答案为:NaCl,NaClO,Na2CO3 ;
(4)得6000kg H2和700kg N2,依据化学方程式N2+3H2=2NH3,若以得到H2和N2为原料想可知氢气过量,依据氮气中氮元素守恒计算,经一系列反应最多可生产碳酸氢铵的质量=
| 700kg |
| 28g/mol |
故答案为:3950.
点评:本题考查了原子、离子结构,物质组成和结构的理解应用,主要是原子晶体、金属金属晶体性质的判断,化学方程式计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列结论均出自《实验化学》中的实验,其中正确的是( )
| A、往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4能从中萃取出碘 |
| B、制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只要将溶液蒸干即可 |
| C、用移液管取液后,将移液管稍倾斜放入垂直的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| D、当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
NA为阿伏伽德罗常数.下列说法正确的是( )
| A、同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| B、32gCu与S完全反应转移的电子数为NA |
| C、1L 1.0mol?L-1 NH4Cl与2L 0.5mol?L-1 NH4Cl溶液含NH4+数目相同 |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA |
下列说法正确的是( )
| A、煤的干馏、石油的分馏都是物理变化 |
| B、工业上常用澄清石灰水和氯气反应制漂白粉 |
| C、蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D、二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |
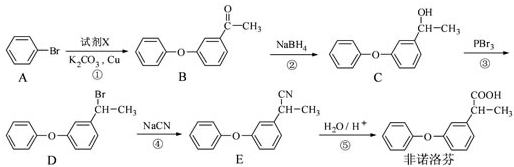
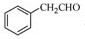 为原料制备
为原料制备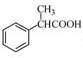 的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
的合成路线流程图(无机试剂任用),合成路线路程图示例如下: