题目内容
有一澄清溶液其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、I-、NO3-、CO32-、SO42-中的几种,取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈现强酸性,排除 的存在.
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4呈紫红色,生成该紫红色物质的离子方程式为 .
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生,则可排除 的存在.取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则证明有 存在.生成该气体的离子方程式为 .
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成,证明 存在,又排除
存在.
(5)综上所述,该溶液中上述离子尚不能确定是否存在的是 .
(6)若要确认(5)中相关的离子,确认的实验方法是 .
(1)用pH试纸检验,表明溶液呈现强酸性,排除
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4呈紫红色,生成该紫红色物质的离子方程式为
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生,则可排除
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成,证明
(5)综上所述,该溶液中上述离子尚不能确定是否存在的是
(6)若要确认(5)中相关的离子,确认的实验方法是
考点:常见阳离子的检验,离子共存问题,常见阴离子的检验
专题:离子反应专题
分析:(1)用pH试纸检验,表明溶液呈现强酸性,碳酸根离子能够与氢离子反应,在溶液中不会存在;
(2)四氯化碳溶液呈紫红色,说明加入氯水后有碘单质生成,原溶液中一定含有碘离子,据此写出反应的离子方程式;
(3)加入氢氧化钠溶液的过程中没有沉淀生成,说明一定不存在Mg2+、Al3+;加热该碱性溶液生成使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明溶液中存在铵根离子,据此写出反应的离子方程式;
(4)结合Ba2+能与碳酸钠反应产生沉淀来判断存在的离子,根据离子共存判断不能存在的离子;
(5)根据以上分析判断不能确定的离子;
(6)根据检验钾离子的方法进行解答.
(2)四氯化碳溶液呈紫红色,说明加入氯水后有碘单质生成,原溶液中一定含有碘离子,据此写出反应的离子方程式;
(3)加入氢氧化钠溶液的过程中没有沉淀生成,说明一定不存在Mg2+、Al3+;加热该碱性溶液生成使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明溶液中存在铵根离子,据此写出反应的离子方程式;
(4)结合Ba2+能与碳酸钠反应产生沉淀来判断存在的离子,根据离子共存判断不能存在的离子;
(5)根据以上分析判断不能确定的离子;
(6)根据检验钾离子的方法进行解答.
解答:
解:(1)溶液为强酸性,则溶液中存在大量氢离子,CO32-能够与氢离子反应,所以原溶液中一定不存在CO32-,
故答案为:CO32-;
(2)CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化生成碘单质,反应的离子方程式为:Cl2+2I-=I2+2Cl-,从而说明溶液中含有I-,而I-与Fe3+、NO3-和H+发生反应而不能共存,说明溶液中肯定不含有Fe3+、NO3-,
故答案为:Cl2+2I-=I2+2Cl-;
(3)溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Mg2+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Mg2+、Al3+;产生的气体能使湿润的红色石蕊试纸变蓝,则该气体为氨气,说明溶液中肯定含NH4+,反应的离子方程式为:NH4++OH-
NH3↑+H2O,
故答案为:Mg2+、Al3+;NH4+;NH4++OH-
NH3↑+H2O;
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-,
故答案为:Ba2+;SO42-;
(5)根据以上分析可知,无法确定原溶液中是否存在K+,
故答案为:K+;
(6)实验室中检验钠离子、钾离子时,通常采用焰色反应,注意观察钾离子的焰色反应火焰颜色时,需要通过蓝色的钴玻璃观察,
故答案为:K+.
故答案为:CO32-;
(2)CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化生成碘单质,反应的离子方程式为:Cl2+2I-=I2+2Cl-,从而说明溶液中含有I-,而I-与Fe3+、NO3-和H+发生反应而不能共存,说明溶液中肯定不含有Fe3+、NO3-,
故答案为:Cl2+2I-=I2+2Cl-;
(3)溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Mg2+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Mg2+、Al3+;产生的气体能使湿润的红色石蕊试纸变蓝,则该气体为氨气,说明溶液中肯定含NH4+,反应的离子方程式为:NH4++OH-
| ||
故答案为:Mg2+、Al3+;NH4+;NH4++OH-
| ||
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-,
故答案为:Ba2+;SO42-;
(5)根据以上分析可知,无法确定原溶液中是否存在K+,
故答案为:K+;
(6)实验室中检验钠离子、钾离子时,通常采用焰色反应,注意观察钾离子的焰色反应火焰颜色时,需要通过蓝色的钴玻璃观察,
故答案为:K+.
点评:本题主要考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的化学性质及检验方法,能够根据离子共存、离子反应现象判断离子共存情况,明确检验离子时,必须排除干扰离子,确保检验方案的严密性.

练习册系列答案
相关题目
下列涉及有机物的性质或应用的说法,不正确的是( )
| A、石油的裂解为深度裂化,产物主要为乙烯等小分子烃 |
| B、油脂“硬化”后性质变的更稳定 |
| C、蔗糖、淀粉、纤维素均会水解,反应后的产物相同 |
| D、2CH3CH2OH+O2→2CH3CHO+2H2O属于氧化反应 |
下列实验装置或操作正确的是( )
A、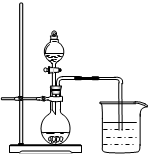 向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、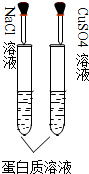 两支试管中蛋白质溶液均会变性 |
C、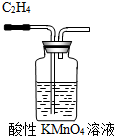 除去C2H4中的SO2 |
D、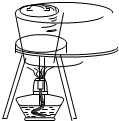 海带灼烧成灰 |
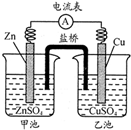 中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )| A、负极发生氧化反应:Cu-2e-=Cu2+ |
| B、电池工作时,盐桥逐渐变蓝 |
| C、向乙池中通入H2S后,电池反应停止 |
| D、若将电极Cu改为石墨,电池电流强度发生变化 |
 下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.