题目内容
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,2克氢气所含原子数目为NA |
| B、4.6克钠与水反应时失去的电子数目为0.2NA |
| C、在标准状况下,22.4LNH3所含的质子数目为NA |
| D、1 L0.5mol?L-1Na2SO4溶液中所含有的Na+离子数目为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据氢气由氢原子构成来分析;
B、根据钠反应后的价态来分析;
C、求出氨气的物质的量,然后根据1mol氨气含10mol质子来分析;
D、求出硫酸钠的物质的量,然后根据1mol硫酸钠含2mol钠离子来计算.
B、根据钠反应后的价态来分析;
C、求出氨气的物质的量,然后根据1mol氨气含10mol质子来分析;
D、求出硫酸钠的物质的量,然后根据1mol硫酸钠含2mol钠离子来计算.
解答:
解:A、氢气由氢原子构成,故2g氢气中含有的氢原子的物质的量为n=
=2mol,个数为2NA,故A错误;
B、4.6g钠的物质的量为0.2mol,而钠反应后的价态为+1价,故0.2mol钠失去0.2mol电子,故B正确;
C、标况下,22.4L氨气的物质的量为1mol,而1mol氨气含10mol质子,故C错误;
D、硫酸钠的物质的量n=CV=0.5mol,而1mol硫酸钠含2mol钠离子,故0.5mol硫酸钠含1mol钠离子,故D错误.
故选B.
| 2g |
| 1g/mol |
B、4.6g钠的物质的量为0.2mol,而钠反应后的价态为+1价,故0.2mol钠失去0.2mol电子,故B正确;
C、标况下,22.4L氨气的物质的量为1mol,而1mol氨气含10mol质子,故C错误;
D、硫酸钠的物质的量n=CV=0.5mol,而1mol硫酸钠含2mol钠离子,故0.5mol硫酸钠含1mol钠离子,故D错误.
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向含有Cu(NO3)2,Zn(NO3)2,Fe(NO3)3,AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌反应后,下列结论错误的是( )
| A、溶液中析出0.05mol Cu |
| B、溶液中析出0.1mol Ag |
| C、溶液中Cu2+与Fe2+的浓度之比为1:2 |
| D、往反应后的溶液中再加入0.1mol 铁粉,铁粉恰好完全溶解 |
下列物质中,属于电解质的是( )
| A、NaOH | B、蔗糖 |
| C、稀盐酸 | D、NaCl溶液 |
区分氢氧化铁胶体与含酚酞的稀氢氧化钠混合溶液最简便有效的方法是( )
| A、滴加盐酸 | B、丁达尔效应 |
| C、过滤 | D、蒸馏 |
用鲍林的杂化轨道理论解释甲烷分子的正四面体结构,下列说法不正确的是( )
| A、C原子的四个杂化轨道的能量一样 |
| B、C原子的sp3杂化轨道之间夹角一样 |
| C、C原子有1个sp3杂化轨道由孤电子对占据 |
| D、C原子的4个价电子分别占据4个sp3杂化轨道 |
下列说法错误的是( )
| A、硝酸的摩尔质量和6.02×1023个硝酸分子的质量(以克为单位)在数值上相等 |
| B、6.02×10个氮气分子和6.02×1023个氢气分子的质量比等于14:1 |
| C、32g氧气所含的原子数目约为2×6.02×1023 |
| D、通常情况下,近似值6.02×1023就是我们所说的阿伏伽德罗常数 |
下列有关化学用语正确的是( )
| A、聚丙烯的链节:-CH2-CH2-CH2- | ||
B、NH4Cl的电子式: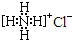 | ||
C、F-结构示意图: | ||
D、中子数为20的氯原子:
|
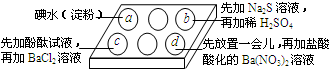 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )