题目内容
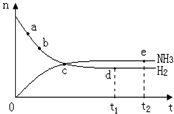 合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g)
| 催化剂 |
| 高温高压 |
| A、点a的正反应速率比b点的大 |
| B、反应达到平衡时,v(N2)正=2v(NH3)逆 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、其他条件不变,500℃下反应至t1时刻,n(H2)比图中d点值大 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:在N2(g)+3H2(g)?2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项.
解答:
解:A.反应物起始浓度最大,正反应速率最大,随着反应进行,浓度降低,反应速率降低,点a的正反应速率比b点大,故A正确;
B.反应速率之比等于化学方程式计量数之比,为正反应速率之比,2v(N2)正=v(NH3)逆,说明反应达到平衡状态,v(N2)正=2v(NH3)逆 ,不能说明反应达到平衡状态,故B错误;
C.点d和点e处,n(NH3)和n(H2)不再发生变化,则已经达到平衡状态,即点d(t1时刻)和点e(t2时刻)处n(N2)一样,故C错误;
D.由于该反应△H<0,反应放热,400℃到500℃,温度升高,化学平衡向逆反应方向移动,即500℃时,n(H2)比图中d点的值大,故D正确;
故选BC.
B.反应速率之比等于化学方程式计量数之比,为正反应速率之比,2v(N2)正=v(NH3)逆,说明反应达到平衡状态,v(N2)正=2v(NH3)逆 ,不能说明反应达到平衡状态,故B错误;
C.点d和点e处,n(NH3)和n(H2)不再发生变化,则已经达到平衡状态,即点d(t1时刻)和点e(t2时刻)处n(N2)一样,故C错误;
D.由于该反应△H<0,反应放热,400℃到500℃,温度升高,化学平衡向逆反应方向移动,即500℃时,n(H2)比图中d点的值大,故D正确;
故选BC.
点评:本题考查化学平衡图象问题,题目难度不大,注意分析图象中各物理量的变化曲线,把握平衡状态的特征为解答该题的关键.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
下列离子方程式正确的是( )
A、等体积、等物质的量浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO
| ||||
| B、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | ||||
| C、1molCl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | ||||
| D、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- |
分类是化学学习与研究的常用方法,下列分类正确的是( )
| A、Na2O、MgO、Al2O3均属于碱性氧化物 |
| B、石灰石、生石灰、熟石灰均属于碱 |
| C、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D、根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,18g H2O含有10nA个电子 |
| B、等物质的量的H2和N2所含分子数均为NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1L0.1mol/L NH4Cl 溶液中含有NH4+数目为0.1NA |
如图所示的装置,有关说法正确的是( )


| A、电子由Cu流向Zn |
| B、Cu是正极,发生氧化反应 |
| C、溶液中Cu2+向Cu电极移动 |
| D、Cu在Zn电极上析出 |
往含Fe3+、H+、NO3-的混合液中加入少量含SO32-的某溶液充分反应后(设溶液中的其他成分不反应),下列表示该混合溶液中发生反应的离子方程式中正确的是( )
| A、2 Fe3++SO32-+H2O→2 Fe2++SO42-+2 H+ |
| B、2 H++SO32-→SO2↑+H2O |
| C、2 H++2 NO3-+3 SO32-→3 SO42-+2 NO+H2O |
| D、2 Fe3++3 SO32-+3 H2O→2 Fe(OH)3↓+3 SO2↑ |
 有机电解制备的金属醇盐,可直接作为制备纳米材料的前体.以下是一种电化学合成金属醇盐的主要装置.在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:
有机电解制备的金属醇盐,可直接作为制备纳米材料的前体.以下是一种电化学合成金属醇盐的主要装置.在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:2CH3CH2OH+2e-=2CH3CH2O-+H2↑
2CH3COCH2COCH3+2e-=2(CH3COCHCOCH3)+H2↑
下列说法正确的是( )
| A、阳极Pb失去电子,发生还原反应 |
| B、当阳极失去2 mol e-时,阴极产生2 mol氢气 |
| C、电解过程中,阳离子向阴极移动 |
| D、已知Pb-4e-=Pb4+,当消耗Pb的质量为103.5 g时,则转移电子2 mol |
下列叙述中错误的是( )
| A、若将等量的硫蒸汽和硫固体分别完全燃烧,恢复到原状态,前者放出的热量多 |
| B、I2、SO3、固态氩都属于分子晶体 |
| C、1 molO2在反应中作氧化剂时,所得电子数一定为4NA |
| D、ag铁粉与含有H2SO4的CuSO4溶液恰好完全反应后,得到的固体为a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为2:7 |



