题目内容
往含Fe3+、H+、NO3-的混合液中加入少量含SO32-的某溶液充分反应后(设溶液中的其他成分不反应),下列表示该混合溶液中发生反应的离子方程式中正确的是( )
| A、2 Fe3++SO32-+H2O→2 Fe2++SO42-+2 H+ |
| B、2 H++SO32-→SO2↑+H2O |
| C、2 H++2 NO3-+3 SO32-→3 SO42-+2 NO+H2O |
| D、2 Fe3++3 SO32-+3 H2O→2 Fe(OH)3↓+3 SO2↑ |
考点:离子方程式的书写
专题:离子反应专题
分析:硝酸根离子在酸性环境下氧化性强于三价铁离子的氧化性,二者都能够氧化亚硫酸根离子,往含Fe3+、H+、NO3-的混合液中加入少量含SO32-的某溶液,亚硫酸根离子先与硝酸根离子反应,依据氧化还原反应规律判断反应产物、配平方程式,据此解答.
解答:
解:硝酸根离子在酸性环境下氧化性强于三价铁离子的氧化性,二者都能够氧化亚硫酸根离子,往含Fe3+、H+、NO3-的混合液中加入少量含SO32-的某溶液,亚硫酸根离子先与硝酸根离子反应,反应的离子方程式为:2H++2NO3-+3SO32-→3SO42-+2NO↑+H2O,
故选:C.
故选:C.
点评:本题考查了离子方程式的书写,明确氧化还原反应的先后规律是解题关键,注意氧化还原方程式的配平,题目难度中等.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
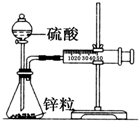 按如图安装好实验装置(装置气密性良好),在锥形瓶内盛6.5g锌粒(相对原子质量Zn-65),通过分液漏斗加入40mL2.5mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到标准状况下的H244.8mL.下列说法不正确的是( )
按如图安装好实验装置(装置气密性良好),在锥形瓶内盛6.5g锌粒(相对原子质量Zn-65),通过分液漏斗加入40mL2.5mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到标准状况下的H244.8mL.下列说法不正确的是( )| A、忽略锥形瓶内溶液体积的变化,用H+来表示10s内该反应的速率0.01mol/(L?s) |
| B、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10s内该反应的速率0.01mol/(L?s) |
| C、用锌粒来表示10s内该反应的速率为0.013g/s |
| D、用H2来表示10s内该反应的速率为0.0002mol/s |
设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A、1mol?L -1的NaClO溶液中含有ClO-的数目为NA |
| B、常温常压下,分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C、标准状况下,11.2 L CH3CH2OH 中含有的氢原子数目为3NA |
| D、室温下,1L pH=13的Ba(OH)2溶液中,OH-离子数目为0.2NA |
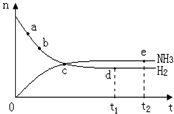 合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g)
| 催化剂 |
| 高温高压 |
| A、点a的正反应速率比b点的大 |
| B、反应达到平衡时,v(N2)正=2v(NH3)逆 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、其他条件不变,500℃下反应至t1时刻,n(H2)比图中d点值大 |
有关说法正确的是( )
| A、0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| B、常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
| C、NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-) |
| D、0.1mol/L的NaHA溶液,其pH=4时:c(HA-)>c(H+)>c(H2A)>c(A2-) |