题目内容
如图所示的装置,有关说法正确的是( )


| A、电子由Cu流向Zn |
| B、Cu是正极,发生氧化反应 |
| C、溶液中Cu2+向Cu电极移动 |
| D、Cu在Zn电极上析出 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:在用锌片、铜片和硫酸铜组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应,铜片作正极,正极上铜离子得电子发生还原反应,电子从负极沿导线流向正极,以此解答.
解答:
解:A.在用锌片、铜片和硫酸铜组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,铜为正极,电子从负极锌流出,流入正极铜,故A错误
B.铜活泼性较锌弱,为原电池的正极,发生还原反应,故B错误;
C.电解质中的阳离子移向正极,Cu为原电池的正极,故C正确;
D.铜电极上析出铜,电极质量逐渐增大,故D错误.
故选C.
B.铜活泼性较锌弱,为原电池的正极,发生还原反应,故B错误;
C.电解质中的阳离子移向正极,Cu为原电池的正极,故C正确;
D.铜电极上析出铜,电极质量逐渐增大,故D错误.
故选C.
点评:本题考查原电池知识,为高考高频考点,侧重于学生的分析能力和基本概念的理解和运用的考查,注意把握原电池的组成以及工作原理,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
配置480mL0.5mol/L的NaOH溶液,有下列仪器:①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥480mL容量瓶、⑦药匙、⑧500mL容量瓶、⑨胶头滴管、⑩坩埚,必须要用到的仪器有( )
| A、①③④⑥⑦⑨ |
| B、①④⑦⑧⑨⑩ |
| C、①②④⑤⑧⑨ |
| D、①③④⑦⑧⑨ |
m克焦炭与x克氧气置于密闭容器中,在一定条件下充分反应后恢复到原来的温度,容器中反应物均无剩余.设反应前后压强分别为P1、P2,以下说法正确的是( )
| A、如果P1=P2,m≥3x/8 |
| B、如果2P1=P2,m≤3x/4 |
| C、如果P1<P2<2P1,3x/4>m>3x/8 |
| D、无论前后压强如何变化,m=3x/8 |
下列说法不正确的是( )
| A、温度相同、体积相同的O2(g)和N2(g)分子数相同 |
| B、等温等压下,SO2气体与CO2气体的密度之比等于16:11 |
| C、温度和容积相同的两气罐中分别盛有5molO2(g)和2mol N2(g),两容积中的压强之比等于5:2 |
| D、等温等压条件下,5molO2(g)和2molH2(g)的体积之比等于5:2 |
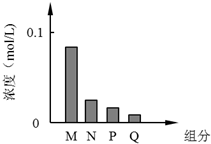 常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )| A、图中N表示HA,P表示OH-,Q表示H+ |
| B、若V=10 mL,则pH=7 |
| C、若V<10 mL,则溶液显酸性 |
| D、若V=10 mL,则:c(M)+c(P)=c(Na+) |
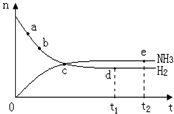 合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g)
| 催化剂 |
| 高温高压 |
| A、点a的正反应速率比b点的大 |
| B、反应达到平衡时,v(N2)正=2v(NH3)逆 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、其他条件不变,500℃下反应至t1时刻,n(H2)比图中d点值大 |
下列有关物质的结构或性质的叙述错误的是( )
| A、水是一种非常稳定的化合物,这是由于氢键所致 |
| B、由极性键形成的分子不一定是极性分子 |
| C、H2O、HF、NH3、CH4的沸点依次降低 |
| D、分子晶体中一定存在分子间作用力,可能有共价键 |
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、标准状况下,22.4 L CH3CH2OH中碳原子数为2NA |
| B、常温常压下,92g NO2和N2O4的混合气体中含有的原子数为6NA |
| C、0.2 mol?L-1 NaHCO3溶液中含Na+数为0.2NA |
| D、标准状况下,22.4L Cl2与足量的铁粉完全反应转移电子数目为3NA |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂.工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4+2Na2SO4下列有关说法不正确的是( )
| A、高铁酸钾与水反应时,水发生还原反应 |
| B、湿法中每生成1molNa2FeO4转移3mol电子 |
| C、干法中每生成1molNa2FeO4转移4mol电子 |
| D、K2FeO4处理水时,不仅能消毒杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降 |