题目内容
 某校研究性学习小组就氮及其化合物展开研究.
某校研究性学习小组就氮及其化合物展开研究.(1)①实验室加热氯化铵和氢氧化钙的固体混合物制取氨气的化学方程式是
②检验氨气的方法是
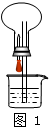
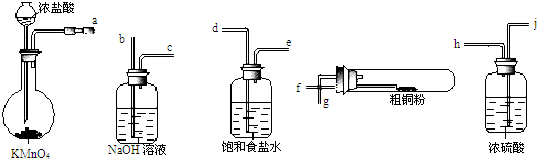
③如图1装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液(括号内物质),挤压胶头滴管的胶头,下列选项与实验事实不相符的是
A.CO2(NaHCO3溶液)形成无色喷泉
B.NH3(H2O含酚酞)形成红色喷泉
C.SO2(NaOH溶液)形成无色喷泉
D.HCl(AgNO3溶液)形成白色喷泉
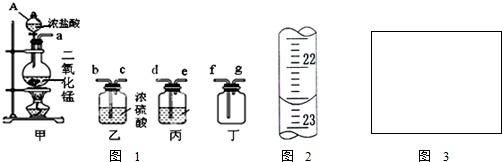
(2)某研究性学习小组用稀硝酸和含有杂质的铜粉通过下列如图2过程制取硝酸铜晶体[Cu(NO3)2?3H2O].
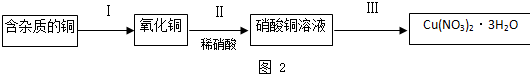
①含有杂质的铜中含有大量的有机物,可以用灼烧的方法除去,灼烧时将坩埚置于
实验用仪器:
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
②在步骤Ⅲ中,必须进行的实验操作是
(3)该小组成员用氨气还原氧化铜的方法测定铜的近似相对原子质量,其化学反应方程式为 3CuO+2NH3
| ||
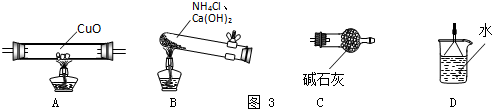
①仪器连接的顺序是
②列出计算铜的近似相对原子质量的表达式
③下列情况将使测定结果偏小的是
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu.
考点:性质实验方案的设计,制备实验方案的设计
专题:实验设计题
分析:(1)①实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;
②氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验,也可以利用氨气和氯化氢气体相遇生成白烟设计实验检验;
③燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛放同一种溶液,挤压胶头滴管,如能形成喷泉,说明气体能溶于溶液或与溶液反应,导致烧瓶内压强减小而形成喷泉,结合题中对应物质的性质解答该题;
(2)铜和氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜,蒸发浓缩、结晶析出硝酸铜晶体,过滤、洗涤、干燥得纯净硝酸铜晶体;
①灼烧时将瓷坩埚置于泥三角上,取用坩埚使用坩埚钳,灼烧后的坩埚应放在石棉网上;
②过滤后滤液为硫酸铜溶液,然后蒸发浓缩、冷却结晶、过滤后洗涤干燥得到晶体;
(3)①按照气体发生装置、除杂装置、性质检验装置、尾气处理装置等顺序组装仪器;
②由反应方程式可知氧化铜和水的物质的量相等,列出关系式,求出铜元素相对原子质量;
③根据Ar(Cu)=
-16,从是否影响m(CuO)和m(H2O)来分析误差.
| ||
②氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验,也可以利用氨气和氯化氢气体相遇生成白烟设计实验检验;
③燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛放同一种溶液,挤压胶头滴管,如能形成喷泉,说明气体能溶于溶液或与溶液反应,导致烧瓶内压强减小而形成喷泉,结合题中对应物质的性质解答该题;
(2)铜和氧气反应生成氧化铜,氧化铜和硝酸反应生成硝酸铜,蒸发浓缩、结晶析出硝酸铜晶体,过滤、洗涤、干燥得纯净硝酸铜晶体;
①灼烧时将瓷坩埚置于泥三角上,取用坩埚使用坩埚钳,灼烧后的坩埚应放在石棉网上;
②过滤后滤液为硫酸铜溶液,然后蒸发浓缩、冷却结晶、过滤后洗涤干燥得到晶体;
(3)①按照气体发生装置、除杂装置、性质检验装置、尾气处理装置等顺序组装仪器;
②由反应方程式可知氧化铜和水的物质的量相等,列出关系式,求出铜元素相对原子质量;
③根据Ar(Cu)=
| 18m(CuO) |
| m(H2O) |
解答:
解:(1)①实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
②氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则证明是氨气;
故答案为:用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气;或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则证明是氨气;
③A.因NaHCO3溶液抑制CO2的溶解,则挤压胶管的胶头,气压变化不明显,则不会形成喷泉,故A错误;
B.因氨气极易溶于水,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因氨水溶液显碱性,酚酞遇碱变红,故形成红色喷泉,故B正确;
C.二氧化硫和氢氧化钠反应生成无色的亚硫酸钠,则挤压胶管的胶头,使烧瓶中的气压减小,而形成无色喷泉,故C正确;
D.因HCl与AgNO3溶液反应生成白色的AgCl沉淀,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因溶液中有白色的AgCl,溶液变白,故形成白色喷泉,故D正确;
故答案为:A;
(2)①用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却,故答案为:c;e;b;
②由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体,故答案为:蒸发浓缩;过滤;
(3)①氨气还原氧化铜时,应先制备氨气,并用碱石灰干燥氨气,生成的氨气在加热条件下与氧化铜反应,生成的水用碱石灰吸收以测定生成水的质量,最后用水吸收氨气,故答案为:BCACD;
②根据反应方程式2NH3+3CuO
3Cu+3H2O+N2;
3 3
可知氧化铜和水的物质的量相等,所以有以下关系式:
=
,解得Ar(Cu)=
-16,故答案为:
-16;
③由②可知Ar(Cu)=
-16,
A.若Cu0未完全起反应,说明m(H2O)偏小,结果偏大;
B.若CuO不干燥,说明m(CuO)偏小,m(H2O)偏大,结果偏低;
C.若Cu0中混有不反应的杂质,说明m(H2O)偏小,结果偏大;
故选B.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
②氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则证明是氨气;
故答案为:用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气;或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则证明是氨气;
③A.因NaHCO3溶液抑制CO2的溶解,则挤压胶管的胶头,气压变化不明显,则不会形成喷泉,故A错误;
B.因氨气极易溶于水,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因氨水溶液显碱性,酚酞遇碱变红,故形成红色喷泉,故B正确;
C.二氧化硫和氢氧化钠反应生成无色的亚硫酸钠,则挤压胶管的胶头,使烧瓶中的气压减小,而形成无色喷泉,故C正确;
D.因HCl与AgNO3溶液反应生成白色的AgCl沉淀,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因溶液中有白色的AgCl,溶液变白,故形成白色喷泉,故D正确;
故答案为:A;
(2)①用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却,故答案为:c;e;b;
②由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体,故答案为:蒸发浓缩;过滤;
(3)①氨气还原氧化铜时,应先制备氨气,并用碱石灰干燥氨气,生成的氨气在加热条件下与氧化铜反应,生成的水用碱石灰吸收以测定生成水的质量,最后用水吸收氨气,故答案为:BCACD;
②根据反应方程式2NH3+3CuO
| ||
3 3
可知氧化铜和水的物质的量相等,所以有以下关系式:
| m(CuO) |
| Ar(Cu)+16 |
| m(H2O) |
| 18 |
| 18m(CuO) |
| m(H2O) |
| 18m(CuO) |
| m(H2O) |
③由②可知Ar(Cu)=
| 18m(CuO) |
| m(H2O) |
A.若Cu0未完全起反应,说明m(H2O)偏小,结果偏大;
B.若CuO不干燥,说明m(CuO)偏小,m(H2O)偏大,结果偏低;
C.若Cu0中混有不反应的杂质,说明m(H2O)偏小,结果偏大;
故选B.
点评:本题主要考查氨气的制备、净化、干燥、氨气的性质及利用方程式进行的计算以及有关误差分析以及硝酸铜的制取,难度不大,本题注意把握实验装置的顺序,为易错点.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
| A、盐酸的浓度 |
| B、铝条的表面积 |
| C、溶液的温度 |
| D、加少量Na2SO4 |
我国的PM2.5大气环境质量标准即将出台.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.PM2.5粒径小,富含大量的有毒、有害物质且在大气中停留时间长,因而对人体健康和大气环境质量影响更大.下列有关说法不正确的是( )
| A、灰霾主要由PM2.5组成 |
| B、PM2.5颗粒直径小,表面积大,吸附能力强,吸附有毒物会增强它的毒性 |
| C、目前我国空气污染指数(API)指标数值范围只包含二氧化硫(SO2)、二氧化氮(NO2)和可吸入颗粒物(PM10)三个指标 |
| D、PM10为可吸入性颗粒,将其纳入空气污染指数(API),是因为其危害比PM2.5更大 |


 已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.
已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.