题目内容
某校研究性学习小组拟利用分光光度法对空气中二氧化硫含量(mg/m3)进行测定.分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析.其工作原理可以简单的用公式表示为A=kc,其中A为吸光度,k为一定条件下的常数,c为溶液浓度.
实验步骤如下:

(1)采样:
①如果你是该小组成员,你对采样的地点和时间有何建议: .
②用如图1所示装置采样,通过50L空气后,将吸收液移入100ml容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用.用多孔球泡而不用导管的原因是 .
(2)吸光度与SO2含量标准曲线的绘制:在6支25ml比色管中,用每毫升含25μg二氧化硫的标准液配置下表标准SO2含量系列.
二氧化硫标准系列
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下.
请在如图2所示的坐标系中绘制标准曲线
(3)准确量取容量瓶中溶液10mL加入比色皿,测得其吸光度值为0.10,则空气中二氧化硫含量为 mg/m3.我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值(mg/m3):一级标准:0.15;二级标准:0.50;三级标准:0.70.则该市空气为 级标准.
(4)甲、乙两组同学测定结果相差较大,乙组同学测定空气中SO2含量偏小,试分析乙组同学出现误差的可能原因: (两个所用药品和装置均无问题).
实验步骤如下:

(1)采样:
①如果你是该小组成员,你对采样的地点和时间有何建议:
②用如图1所示装置采样,通过50L空气后,将吸收液移入100ml容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用.用多孔球泡而不用导管的原因是
(2)吸光度与SO2含量标准曲线的绘制:在6支25ml比色管中,用每毫升含25μg二氧化硫的标准液配置下表标准SO2含量系列.
二氧化硫标准系列
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 标准液(ml) | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
| 吸收液(ml) | 10.00 | 9.80 | 9.60 | 9.40 | 9.20 | 9.00 |
| 二氧化硫含量(μg) | 0 | 5.00 | 10.00 | 15.00 | 20.00 | 25.00 |
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 吸光度 | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
(3)准确量取容量瓶中溶液10mL加入比色皿,测得其吸光度值为0.10,则空气中二氧化硫含量为
(4)甲、乙两组同学测定结果相差较大,乙组同学测定空气中SO2含量偏小,试分析乙组同学出现误差的可能原因:
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)①不同时间段,不同地点,二氧化硫的含量可能不同,故采样要尽量包含面广;
②气体与溶液的接触面积越大,反应越充分;
(2)利用实验中记录到的标准溶液的吸光度与浓度的数值,根据所给数据描点作出标准溶液的吸光度随浓度变化的曲线;
(3)分析表中数据可知浓度增大5ug/L,吸光度增大0.2,所以浓度和吸光度呈正比,据此计算待测液的浓度;
(4)从二氧化硫和吸收液的反应情况分析.
②气体与溶液的接触面积越大,反应越充分;
(2)利用实验中记录到的标准溶液的吸光度与浓度的数值,根据所给数据描点作出标准溶液的吸光度随浓度变化的曲线;
(3)分析表中数据可知浓度增大5ug/L,吸光度增大0.2,所以浓度和吸光度呈正比,据此计算待测液的浓度;
(4)从二氧化硫和吸收液的反应情况分析.
解答:
解:(1)①不同时间段,不同地点,二氧化硫的含量可能不同,故采样要尽量包含面广,
故答案为:在不同地点、不同时间采样,如学校、工厂、居民区附近;早晨、中午、晚上分别采样;
②多孔的球泡,可以增大空气与吸收液的接触面积,使空气中的二氧化硫反应充分,有利于提高实验的准确度,
故答案为:使二氧化硫能被吸收液充分吸收;
(2)利用实验中记录到的标准溶液的吸光度与浓度的数值,根据所给数据描点作出标准溶液的吸光度随浓度变化的曲线如图所示: ,
,
故答案为: ;
;
(3)吸光度和浓度呈正比关系,测得其吸光度值为0.10,设二氧化硫浓度为x,则x=
×0.10=2.5ug,则50L空气中含二氧化硫为:2.5ug×10=25ug,1立方米含二氧化硫为;25ug×
=500ug=0.5mg,为二级标准,故答案为:0.5;二级标准;
(4)抽气速度过快,二氧化硫不能被吸收液吸收完全,是导致乙组同学测定空气中SO2含量偏小的主要原因,
故答案为:抽气速率过快,造成空气中SO2与吸收液未充分反应,产生较大误差.
故答案为:在不同地点、不同时间采样,如学校、工厂、居民区附近;早晨、中午、晚上分别采样;
②多孔的球泡,可以增大空气与吸收液的接触面积,使空气中的二氧化硫反应充分,有利于提高实验的准确度,
故答案为:使二氧化硫能被吸收液充分吸收;
(2)利用实验中记录到的标准溶液的吸光度与浓度的数值,根据所给数据描点作出标准溶液的吸光度随浓度变化的曲线如图所示:
 ,
,故答案为:
 ;
;(3)吸光度和浓度呈正比关系,测得其吸光度值为0.10,设二氧化硫浓度为x,则x=
| 5.00ug |
| 0.20 |
| 1000L |
| 50L |
(4)抽气速度过快,二氧化硫不能被吸收液吸收完全,是导致乙组同学测定空气中SO2含量偏小的主要原因,
故答案为:抽气速率过快,造成空气中SO2与吸收液未充分反应,产生较大误差.
点评:本题考查了实验探究物质性质和含量的设计与实验分析判断,注意过程中的操作步骤理解应用,图象和数据的分析归纳是解题关键,题目难度中等.

练习册系列答案
相关题目
钢铁腐蚀发生得最普遍的是( )
| A、化学腐蚀 | B、析氢腐蚀 |
| C、吸氧腐蚀 | D、摩擦 |
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A、若有l mol NO3-参加还原反应,则转移8mol e- |
| B、还原产物为NH4+ |
| C、氧化剂与还原剂的物质的量之比为8:l |
| D、若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+ |
下列溶液中,Na+数目最多的是( )
| A、1 mol?L-1 Na2SO4溶液100mL |
| B、0.9 mol?L-1Na3PO4溶液100mL |
| C、2.5 mol?L-1NaOH 溶液100mL |
| D、1 mol?L-1 NaHCO3溶液100mL |
下列有关化学用语正确的是( )
A、中子数为18的氯原子结构示意图: | ||
B、质量数为37的氯原子:
| ||
C、Cl-的结构示意图: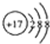 | ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
 某校研究性学习小组就氮及其化合物展开研究.
某校研究性学习小组就氮及其化合物展开研究.
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.
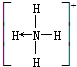 (→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式
(→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式