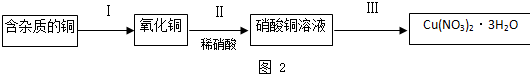
题目内容
A、B、C、D为短周期元素,请根据下表信息回答问题.
(1)B在气态氢化物的电子式为: .
(2)工业上电解法冶炼单质C的化学方程式为: .
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质;D的单质与A的另一种氢化物反应生成A的单质.有关反应的化学方程式为: ; .
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(2)工业上电解法冶炼单质C的化学方程式为:
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质;D的单质与A的另一种氢化物反应生成A的单质.有关反应的化学方程式为:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D为短周期元素,工业上通过分离液态空气获得A的单质,且其单质能助燃,则A为O元素;B的气态氢化物显碱性,则B为N元素;C形成+3价阳离子的核外电子排布与氖原子相同,则C为Al;D在第三周期中原子半径最小,则D为Cl,据此解答.
解答:
解:A、B、C、D为短周期元素,工业上通过分离液态空气获得A的单质,且其单质能助燃,则A为O元素;B的气态氢化物显碱性,则B为N元素;C形成+3价阳离子的核外电子排布与氖原子相同,则C为Al;D在第三周期中原子半径最小,则D为Cl,
(1)B为N元素,气态氢化物的电子式为 ,
,
故答案为: ;
;
(2)工业上电解熔融的氧化铝冶炼Al,反应化学方程式为:2Al2O3(熔融)
4Al+3O2↑,
故答案为:2Al2O3(熔融)
4Al+3O2↑;
(3)氯气与水反应生成具有漂白性的物质,反应方程式为:Cl2+H2O=HCl+HClO;
氯气与过氧化氢反应生成氧气,同时生成HCl,反应方程式为:Cl2+H2O2=2HCl+O2,
故答案为:Cl2+H2O=HCl+HClO;Cl2+H2O2=2HCl+O2;
(1)B为N元素,气态氢化物的电子式为
 ,
,故答案为:
 ;
;(2)工业上电解熔融的氧化铝冶炼Al,反应化学方程式为:2Al2O3(熔融)
| ||
| 冰晶石 |
故答案为:2Al2O3(熔融)
| ||
| 冰晶石 |
(3)氯气与水反应生成具有漂白性的物质,反应方程式为:Cl2+H2O=HCl+HClO;
氯气与过氧化氢反应生成氧气,同时生成HCl,反应方程式为:Cl2+H2O2=2HCl+O2,
故答案为:Cl2+H2O=HCl+HClO;Cl2+H2O2=2HCl+O2;
点评:本题考查结构性质位置关系应用,侧重对物质性质及化学用语的考查,难度不大,明确元素即可解答,答题时注意化学用语的规范表达.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关化学用语正确的是( )
A、中子数为18的氯原子结构示意图: | ||
B、质量数为37的氯原子:
| ||
C、Cl-的结构示意图: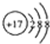 | ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中(如图 1),使其发生反应,t0时容器Ⅰ中达到化学平衡,X(g)、Y(g)、Z(g)的物质的量的变化如图2所示.则下列有关推断正确的是( )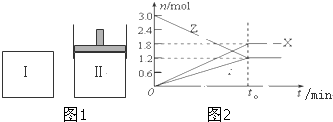

| A、该反应的化学方程式为:3X+2Y?2Z |
| B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 |
| C、两容器中均达到平衡时,Z的物质的量分数相同 |
| D、达平衡后,V(x)为1.8/t0 mol/(L?min) |
 某校研究性学习小组就氮及其化合物展开研究.
某校研究性学习小组就氮及其化合物展开研究.