题目内容
某化学小组用下列装置制取收集纯净的氯气,并研究其性质.请回答下列问题.
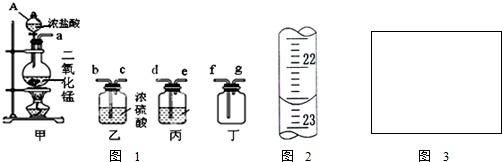
(1)如图1装置甲中仪器A的名称是 ,丙中应装的溶液是 ,甲装置中发生反应的离子方程式为 .制取收集纯净氯气的装置接口连接顺序是a→…→g(补充完整) .
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量.
Ⅱ方案:采用酸碱中和滴定法测定.
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量.
继而进行下列判断和实验:
①判定I方案不可行,理由是 ;
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样.
a.量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响? (填“是”或“无”).用0.10mol?L-1 NaOH标准溶液滴定,消耗NaOH标准溶液的体积如图2所示,其读数为 mL.
b.平行滴定后获得实验结果
③判断Ⅲ方案的实验结果 (填“偏大”、“偏小”或“准确”).[已知:Ksp(CaCO3 )=2.8×10-9、Ksp(MnCO3)=2.3×10-11
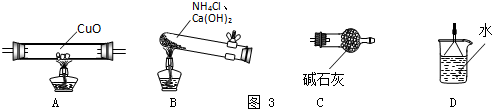
(3)某同学认为上述方案缺少尾气吸收装置,请在如图3的方框中画出该装置并注明试剂.

(1)如图1装置甲中仪器A的名称是
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量.
Ⅱ方案:采用酸碱中和滴定法测定.
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量.
继而进行下列判断和实验:
①判定I方案不可行,理由是
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样.
a.量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?
b.平行滴定后获得实验结果
③判断Ⅲ方案的实验结果
(3)某同学认为上述方案缺少尾气吸收装置,请在如图3的方框中画出该装置并注明试剂.
考点:性质实验方案的设计
专题:实验设计题
分析:(1)甲装置用来制取氯气,氯气中混有挥发的氯化氢,故丙装置应为除杂装置,除去氯气中氯化氢,乙装置有浓硫酸,应为干燥装置,丁装置为排空法收集氯气装置;
(2)①Ⅰ方案:二氧化锰与浓盐酸反应生成二氯化锰,二氯化锰也会与硝酸银反应,故反应不可行;
②Ⅱ方案:锥形瓶中含少量水,不影响试样的物质的量;根据图二读取数据;
③Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大;
(3)氯气有毒不能直接排放,易污染空气.
(2)①Ⅰ方案:二氧化锰与浓盐酸反应生成二氯化锰,二氯化锰也会与硝酸银反应,故反应不可行;
②Ⅱ方案:锥形瓶中含少量水,不影响试样的物质的量;根据图二读取数据;
③Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大;
(3)氯气有毒不能直接排放,易污染空气.
解答:
解:(1)实验室制备氯气的反应原理:MnO2+4HCl
MnCl2+Cl2↑+2H2O,则离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,甲装置用来制取氯气,A为分液漏斗用来滴加浓盐酸;从甲装置出来的气体含有氯化氢和水蒸气,浓硫酸具有吸水性,装置乙中浓硫酸的作用干燥氯气;氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以装置丙中可以盛放饱和食盐水除去氯气中的氯化氢,依次通过丙、乙,氯气密度比空气密度大,用向上排气法收集(长进短出),所以按照气流方向各仪器接口的连接顺序为a→d→e→b→c→f→g,
故答案为:分液漏斗;饱和NaCl溶液;MnO2+4H++2Cl-
Mn2+2+Cl2↑+2H2O;d→e→b→c→f;
(2)①Ⅰ方案:与足量AgNO3溶液反应,氯化锰和盐酸都和硝酸银反应生成氯化银沉淀,称量生成的AgCl质量,只能求出氯离子的量,而不能求出剩余盐酸的浓度;
故答案为:残余液中的MnCl2也会与AgNO3反应形成沉淀;
②Ⅱ方案:锥形瓶中含少量水,不影响试样的物质的量;根据图二读取数据为:22.60mL;故答案为:无;22.60;
③Ⅲ方案:根据Ksp(CaCO3)=2.8×10-9sp(MnCO3)=2.3×10-11知碳酸锰的Ksp比碳酸钙小,由于部分碳酸钙转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小,
故答案为:偏小;
(3)用盛氢氧化钠溶液的烧杯吸收过量的氯气防止污染空气,装置为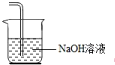 ,故答案为:
,故答案为: .
.
| ||
| ||
故答案为:分液漏斗;饱和NaCl溶液;MnO2+4H++2Cl-
| ||
(2)①Ⅰ方案:与足量AgNO3溶液反应,氯化锰和盐酸都和硝酸银反应生成氯化银沉淀,称量生成的AgCl质量,只能求出氯离子的量,而不能求出剩余盐酸的浓度;
故答案为:残余液中的MnCl2也会与AgNO3反应形成沉淀;
②Ⅱ方案:锥形瓶中含少量水,不影响试样的物质的量;根据图二读取数据为:22.60mL;故答案为:无;22.60;
③Ⅲ方案:根据Ksp(CaCO3)=2.8×10-9sp(MnCO3)=2.3×10-11知碳酸锰的Ksp比碳酸钙小,由于部分碳酸钙转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小,
故答案为:偏小;
(3)用盛氢氧化钠溶液的烧杯吸收过量的氯气防止污染空气,装置为
 ,故答案为:
,故答案为: .
.
点评:本题考查了氯气的制备和氯气性质及沉淀溶解平衡的移动,题目难度不大,注意除去水蒸气和氯化氢杂质顺序的判断.

练习册系列答案
相关题目
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A、若有l mol NO3-参加还原反应,则转移8mol e- |
| B、还原产物为NH4+ |
| C、氧化剂与还原剂的物质的量之比为8:l |
| D、若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+ |
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中(如图 1),使其发生反应,t0时容器Ⅰ中达到化学平衡,X(g)、Y(g)、Z(g)的物质的量的变化如图2所示.则下列有关推断正确的是( )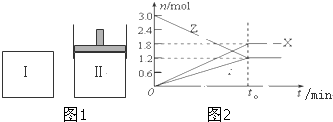

| A、该反应的化学方程式为:3X+2Y?2Z |
| B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 |
| C、两容器中均达到平衡时,Z的物质的量分数相同 |
| D、达平衡后,V(x)为1.8/t0 mol/(L?min) |
下列说法正确的是( )
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |
下列事实中,不能用勒夏特列原理解释的是( )
| A、盛有NO2和N2O4 混合气体的烧瓶置于热水中,气体颜色变深 |
| B、工业合成氨选择500℃左右的温度比室温有利 |
| C、实验室中常用排饱和食盐水的方法收集Cl2 |
| D、合成氨时采用循环操作及将氨液化分离,可提高原料的利用率 |
 某校研究性学习小组就氮及其化合物展开研究.
某校研究性学习小组就氮及其化合物展开研究.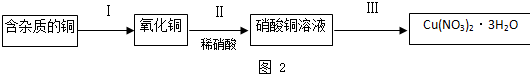
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.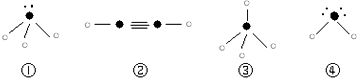
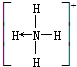 (→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式
(→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式