题目内容
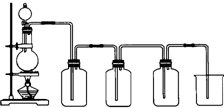 已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.
已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.(1)制取Cl2.如图是实验室制取的Cl2的装置图,写出实验室制Cl2的化学反应方程式:
(2)制备反应产物.将一根细的纯铁丝分别在足量和少量的Cl2中点燃.取其表面生成物配成溶液,并分别编号为A、B,然后通过实验确定其成分.
(3)探究过程如下:Ⅰ.提出假设:①生成物是FeCl3,②生成物是FeCl2.
Ⅱ.设计实验方案:分别取A、B的溶液进行以下两组实验,但每组实验现象相同.请填写下表中的空格.
| 实验方法 | 实验现象 | 结论 |
| 第一组:分别向A、B溶液中加KSCN溶液 | 固体物质中含有FeCl3 | |
| 第二组:分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 |
(4)实验室中使用的FeCl3药品的含量通常可用碘量法测定.主要过程为:称取6.5g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液后,再用0.1mol.L-1Na2S2O3溶液滴定,到达滴定终点时用去Na2S2O3溶液20.00mL.(已知:I2+2S2O32-═2I-+S4O62-)
①Na2S2O3溶液装在
②滴定终点的判断:
③样品中氯化铁的质量分数为:
考点:性质实验方案的设计
专题:实验设计题
分析:(1)利用二氧化锰的氧化性氧化浓盐酸中的氯化氢制取氯气;装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(3)三价铁离子遇到硫氰酸根显红色,氯气和金属铁反应的产物是氯化铁,不会生成亚铁盐;高锰酸钾具有氧化性,可以将亚铁离子氧化为黄色的三价铁离子;
(4)①硫代硫酸钠显示碱性;
②滴入最后一滴,溶液颜色由蓝色变为无色,半分钟不再变色,说明滴定到终点;
③20.00mLNa2S2O3溶液含有Na2S2O3物质的量可以计算,根据关系式2Fe3+~I2~S2O32-计算n(Fe3+),氯化铁的物质的量等于n(Fe3+),利用m=nM计算氯化铁的质量,根据质量分数定义计算.
(3)三价铁离子遇到硫氰酸根显红色,氯气和金属铁反应的产物是氯化铁,不会生成亚铁盐;高锰酸钾具有氧化性,可以将亚铁离子氧化为黄色的三价铁离子;
(4)①硫代硫酸钠显示碱性;
②滴入最后一滴,溶液颜色由蓝色变为无色,半分钟不再变色,说明滴定到终点;
③20.00mLNa2S2O3溶液含有Na2S2O3物质的量可以计算,根据关系式2Fe3+~I2~S2O32-计算n(Fe3+),氯化铁的物质的量等于n(Fe3+),利用m=nM计算氯化铁的质量,根据质量分数定义计算.
解答:
解:(1)实验室制Cl2的化学反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,将导管的一端放入水中,用手捂住烧瓶一会儿,若导管口有连续的气泡冒出时,并在导管口形成一高于液面的稳定水柱,则气密性好.
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;将导管的一端放入水中,用手捂住烧瓶一会儿,若导管口有连续的气泡冒出时,并在导管口形成一高于液面的稳定水柱,则气密性好.
(3)A是FeCl3,B是FeCl2,分别向A、B溶液中加KSCN溶液,只有三价铁离子遇到硫氰酸根显红色,高锰酸钾具有氧化性,可以将亚铁离子氧化为黄色的三价铁离子,KMnO4溶液颜色无明显变化,固体物质中不含FeCl2,故答案为:溶液变红色;固体物质中不含FeCl2;
(4)①硫代硫酸钠水解显示碱性,应该用碱式滴定管,故答案为:碱式;
②滴入最后一滴,溶液颜色由蓝色变为无色,半分钟内不再变色,说明滴定到终点.
故答案为:滴入最后一滴,溶液颜色由蓝色变为无色,半分钟内不再变色.
③20.00mLNa2S2O3溶液含有Na2S2O3物质的量为20.00×10-3 L×0.1mol/L=2×10-3 mol,则:
根据关系式:2Fe3+~~~~~I2~~~~~~2S2O32-
2 2
n(Fe3+) 2×10-3mol×10
所以 n(Fe3+)=2×10-3 mol×10=0.02mol,
无水氯化铁样品中氯化铁的质量为0.02mol×162.5g/mol=3.25g
所以无水氯化铁样品中氯化铁的质量分数为
×100%=50.0%.
故答案为:50.0%.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(3)A是FeCl3,B是FeCl2,分别向A、B溶液中加KSCN溶液,只有三价铁离子遇到硫氰酸根显红色,高锰酸钾具有氧化性,可以将亚铁离子氧化为黄色的三价铁离子,KMnO4溶液颜色无明显变化,固体物质中不含FeCl2,故答案为:溶液变红色;固体物质中不含FeCl2;
(4)①硫代硫酸钠水解显示碱性,应该用碱式滴定管,故答案为:碱式;
②滴入最后一滴,溶液颜色由蓝色变为无色,半分钟内不再变色,说明滴定到终点.
故答案为:滴入最后一滴,溶液颜色由蓝色变为无色,半分钟内不再变色.
③20.00mLNa2S2O3溶液含有Na2S2O3物质的量为20.00×10-3 L×0.1mol/L=2×10-3 mol,则:
根据关系式:2Fe3+~~~~~I2~~~~~~2S2O32-
2 2
n(Fe3+) 2×10-3mol×10
所以 n(Fe3+)=2×10-3 mol×10=0.02mol,
无水氯化铁样品中氯化铁的质量为0.02mol×162.5g/mol=3.25g
所以无水氯化铁样品中氯化铁的质量分数为
| 3.25g |
| 6.5g |
故答案为:50.0%.
点评:本题考查学生对性质实验方案设计题的掌握,难度大,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.注意(4)中计算,mg样品需要Na2S2O3的体积为滴定中的10倍,容易忽略.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、原电池反应是自发的氧化还原反应,盐桥的作用是平衡正负极电荷,形成闭合回路 |
| B、为防止轮船发生腐蚀,往往在轮船外壳焊上金属锌,这是牺牲阴极的阳极保护法 |
| C、精炼铜时,粗铜做阳极,纯铜做阴极,CuSO4是电解质溶液,电解前后溶液浓度不变 |
| D、电镀是特殊的电解,电解前后阴极减少的质量与阳极增加的质量相等 |
下列事实中,不能用勒夏特列原理解释的是( )
| A、盛有NO2和N2O4 混合气体的烧瓶置于热水中,气体颜色变深 |
| B、工业合成氨选择500℃左右的温度比室温有利 |
| C、实验室中常用排饱和食盐水的方法收集Cl2 |
| D、合成氨时采用循环操作及将氨液化分离,可提高原料的利用率 |
下列物质,不能作为从溴水中萃取溴的溶剂的是( )
| A、四氯化碳 | B、酒精 |
| C、苯 | D、二氯甲烷 |
在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成了2mol C,经测定D的浓度为0.5mol?L-1,下列判断正确的是( )
| A、X=3 |
| B、A的转化率为50% |
| C、平衡时B的浓度为1.5 mol?L-1 |
| D、达到平衡时,在相同温度下容器内混合气体的压强是反应前的95% |
 某校研究性学习小组就氮及其化合物展开研究.
某校研究性学习小组就氮及其化合物展开研究.
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.
 (→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式
(→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式