题目内容
17.研究表明丰富的CO2完全可以作为新能源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气.图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.
①能判断该反应向正反应方向进行的是:B
A.v正(H2)=3v逆(CH3OH)

B.容器中混合气体的密度变大
C.容器中压强不变
D.2个C=O断裂的同时有6个H-H形成
②上述反应其他条件保持不变,在恒容条件下进行,平衡时H2的转化率将变小(填“变大”“变小”或“不变”)
③写出上述反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ•mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值:$\frac{1}{6}$(填具体值或取值范围)
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为2mol,则此时v正<v逆(填“<”“>”或“=”)
(3)甲醇在一定条件下能转化为甲醛,碘量滴定法是测定甲醛的化学方法之一,其原理是在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,后将溶液中游离的甲醛氧化为甲酸钠,经适当酸化后,剩余的次碘酸钠和碘化钠又生成碘,上述过程中甲醛参与的化学反应的离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O.
分析 (1)由反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O可知;
①A.v正(H2)=3v正(CH3OH)=3v逆(CH3OH),达平衡状态;
B.容器中混合气体的密度变大,说明平均摩尔质量变大,平衡正向移动;
C.容器中压强不变,说明各物质的量不变,反应达平衡状态;
D.2个C=O断裂的同时有6个H-H生成,说明正逆反应速率相等,反应达到平衡状态;
②上述反应其他条件保持不变,在恒容条件下进行,相当在恒压的基础上减小压强,平衡逆向移动,H2的转化率将变小;
③根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,然后按比例计算:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的△H得出该反应的热化学方程式;
(2)①650℃时,CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):4 2 0 0
转化(mol):1.6 1.6 1.6 1.6
平衡(mol):2.4 0.4 1.6 1.6
所以K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.8×0.8}{1.2×0.2}$=2.67;
900℃时,CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
转化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
由于反应前后气体的体积不变,用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.4×0.4}{1.6×0.6}$=$\frac{1}{6}$,平衡常数减小,说明正反应是放热反应;
②根据方程式可知,参加反应CO、水的物质的量相等,结合CO的转化率大于水蒸气的转化率判断;
③利用三段式计算平衡时各组分物质的量,由于反应前后气体的体积不变,用物质的量代替浓度代入平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算,由于反应前后气体的体积不变,用物质的量代替浓度计算产生的浓度商Qc,与平衡常数相比,判断反应进行方向,进而判断v(正)、v(逆)的相对大小;
(3)甲醛被氧化成甲酸,而碘酸根被还原成碘离子,所以离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O.
解答 解:(1)由反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O可知;
①A.v正(H2)=3v正(CH3OH)=3v逆(CH3OH),达平衡状态,故不符合;
B.容器中混合气体的密度变大,说明平均摩尔质量变大,平衡正向移动,故符合;
C.容器中压强不变,说明各物质的量不变,反应达平衡状态,故不符合;
D.2个C=O断裂的同时有6个H-H生成,说明正逆反应速率相等,反应达到平衡状态,故不符合;
故选B.
②上述反应其他条件保持不变,在恒容条件下进行,相当在恒压的基础上减小压强,平衡逆向移动,H2的转化率将变小,故答案为:变小;
③根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,则该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-$\frac{19.6mol}{80%}$×2=-49kJ•mol-1,故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49 kJ•mol-1;
(2)①650℃时,CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):4 2 0 0
转化(mol):1.6 1.6 1.6 1.6
平衡(mol):2.4 0.4 1.6 1.6
所以K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.8×0.8}{1.2×0.2}$=2.67;
900℃时,CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
转化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
由于反应前后气体的体积不变,用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.4×0.4}{1.6×0.6}$=$\frac{1}{6}$,所以升高温度平衡常数减小,所以正反应是放热反应,即△H<0,故答案为:<;
②根据方程式可知,参加反应CO、水的物质的量相等,令其物质的量均为x,CO的转化率大于水蒸气的转化率,则$\frac{x}{a}$>$\frac{x}{b}$,且a、b均不为0,整理得0<$\frac{a}{b}$<1,
故答案为:0<$\frac{a}{b}$<1;
③CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
转化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
由于反应前后气体的体积不变,用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.4×0.4}{1.6×0.6}$=$\frac{1}{6}$,
若900℃时,在此容器中加入CO、H2O、CO2、H2均为2mol时,浓度均为1mol/L,此时浓度商Qc=$\frac{1×1}{1×1}$=1<K=$\frac{1}{6}$,故反应向逆反应进行,则此时v(正)<v(逆),
故答案为:<;
(3)甲醛被氧化成甲酸,而碘酸根被还原成碘离子,所以离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O,故答案为:HCHO+IO-+OH-=HCOO-+I-+H2O.
点评 本题属于拼合型题目,涉及化学平衡进行方向的判断、化学平衡计算、平衡常数计算及应用、热化学方程式书写等,化学平衡常数的计算及应用是近几年高考常考知识点,是学生综合能力的考查,难度中等.

| A. | 粉末中一定有Na2O、Na202、NaHC03 | |
| B. | 粉末中一定不含有Na2C03和NaCl | |
| C. | 粉末中一定不含有Na20和NaCl | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaC1 |
| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |
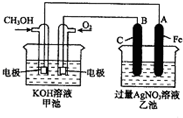 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O Ⅰ
Ⅰ CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点. 或
或
 .
. .
. ,1molB完全燃烧时耗氧9mol
,1molB完全燃烧时耗氧9mol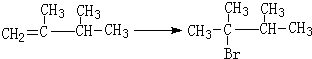
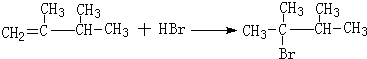
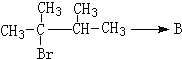
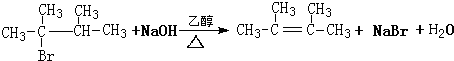 .
.