题目内容
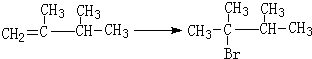
9.已知①不对称烯烃与不对称加成物在不同的条件下有不同的加成方式,如:
HX+CH3-CH═
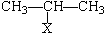 Ⅰ
ⅠHX+CH3-CH═CH2$\stackrel{H_{2}O_{2}}{→}$CH3-CH2-CH2XⅡ(X为卤素原子)
②烃基上的卤素原子在一定条件下能发生取代反应,如:
CH3-CH2-Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2-OH+BaBr
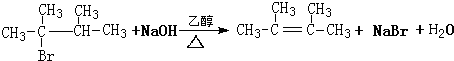
也能发生消去反应,如:
CH3-CH2-Br+NaOH$→_{△}^{乙醇}$CH2=CH2+NaBr+H2O
对溴苯乙烯(Br
 CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空:
(1)写出该共聚物的结构简式
 或
或
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体Br
 CHBrCH3.
CHBrCH3.写出该两步反应所需的试剂及条件.液溴和Fe作催化剂;溴蒸气和光照
(3)将Br
 CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.
CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.写出生成A的化学方程式
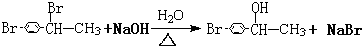 .
.由上述反应可推知苯环上的卤素原子比侧链的卤素原子难发生取代反应,由A生成对溴苯乙烯的反应方程式为
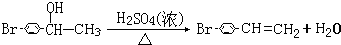 .
.(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面.
写出B的结构简式.
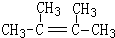 ,1molB完全燃烧时耗氧9mol
,1molB完全燃烧时耗氧9mol完成下列获得B的化学方程式(条件错误不得分):
①
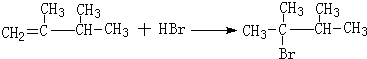
②
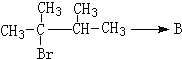
 .
.
分析 (1)对溴乙苯和丙烯能发生加聚反应,连接对溴乙苯中亚甲基的可能是丙烯中中间碳原子也可能是连接碳碳双键的边上的碳原子;
(2)乙苯和溴发生取代反应时需要溴化铁作催化剂;苯环上H原子被溴取代时需要光照条件;
(3)得到A时没有苯环上化学键断裂和生成,说明连接亚甲基的溴原子发生取代反应;
由此可见苯环上的卤素原子比侧链的卤素原子难发生取代反应;根据反应物、生成物和反应条件书写方程式;
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面,则B结构简式为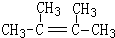 ,B的分子式为C6H12,1mol该物质耗氧量=(6+$\frac{12}{4}$)mol;
,B的分子式为C6H12,1mol该物质耗氧量=(6+$\frac{12}{4}$)mol;
①该反应为2,3-二甲基和HBr的加成反应;
②该反应为消去反应,需要NaOH的醇溶液和加热条件.
解答 解:(1)对溴乙苯和丙烯能发生加聚反应,连接对溴乙苯中亚甲基的可能是丙烯中中间碳原子也可能是连接碳碳双键的边上的碳原子,所以所得结构简式为 或
或 ,故答案为:
,故答案为: 或
或 ;
;
(2)乙苯和溴发生取代反应时需要溴化铁作催化剂,所以需要液溴和Fe作催化剂;苯环上H原子被溴取代时需要光照条件,所以需要溴蒸气和光照,
故答案为:液溴和Fe作催化剂;溴蒸气和光照;
(3)得到A时没有苯环上化学键断裂和生成,说明连接亚甲基的溴原子发生取代反应,反应方程式为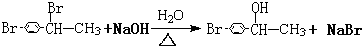 ;
;
由此可见苯环上的卤素原子比侧链的卤素原子难发生取代反应;根据反应物、生成物和反应条件书写方程式为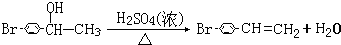 ,
,
故答案为: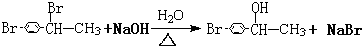 ;苯环上的卤素原子比侧链的卤素原子难发生取代反应;
;苯环上的卤素原子比侧链的卤素原子难发生取代反应;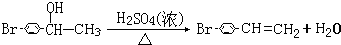 ;
;
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面,则B结构简式为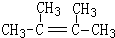 ,B的分子式为C6H12,1mol该物质耗氧量=(6+$\frac{12}{4}$)mol=9mol,
,B的分子式为C6H12,1mol该物质耗氧量=(6+$\frac{12}{4}$)mol=9mol,
故答案为: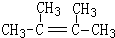 ;9;
;9;
①该反应为2,3-二甲基和HBr的加成反应,反应方程式为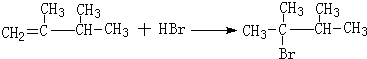 ,故答案为:
,故答案为: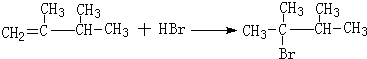 ;
;
②该反应为消去反应,需要NaOH的醇溶液和加热条件,反应方程式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断及有机物结构和性质,为高频考点,明确官能团及其性质关系,注意结合题给信息进行分析解答,侧重考查学生分析及知识运用能力,熟悉常见有机物性质及有机反应类型,题目难度不大.

(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气.图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.
①能判断该反应向正反应方向进行的是:B
A.v正(H2)=3v逆(CH3OH)

B.容器中混合气体的密度变大
C.容器中压强不变
D.2个C=O断裂的同时有6个H-H形成
②上述反应其他条件保持不变,在恒容条件下进行,平衡时H2的转化率将变小(填“变大”“变小”或“不变”)
③写出上述反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ•mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值:$\frac{1}{6}$(填具体值或取值范围)
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为2mol,则此时v正<v逆(填“<”“>”或“=”)
(3)甲醇在一定条件下能转化为甲醛,碘量滴定法是测定甲醛的化学方法之一,其原理是在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,后将溶液中游离的甲醛氧化为甲酸钠,经适当酸化后,剩余的次碘酸钠和碘化钠又生成碘,上述过程中甲醛参与的化学反应的离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O.
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(2)醇可发生分子内脱水生成烯烃,如C2H5OH$?_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
请回答有关问题
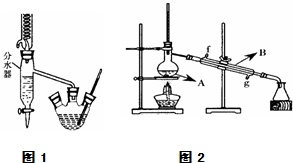
Ⅰ.乙酸正丁酯粗产品的制备
在三孔圆底烧瓶中装入沸石,加入18.5mL正丁醇和15.4mL冰醋酸(稍过量),再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)三孔烧瓶和蒸馏烧瓶在加热时都需要加入沸石,加入沸石是作用是防暴沸.本实验过程中可能产生多种有机副产品,请写成其中一种的结构简式CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3.
(2)反应时加热有利于提高酯的产率,但实验发现温度过高酯的产率反而降低,可能的原因是乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
Ⅱ.乙酸正丁酯粗产品的精制.
(3)将三孔圆底烧瓶中的产物转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,接下来进行的操作名称是分液.
(4)将酯层采用如图2所示装置蒸馏.
①图2中仪器B的名称为冷凝管,水的流向应该从g(“f”或“g”)口进入.
②蒸馏收集乙酸正丁酯粗产品时,应将温度控制在126.1℃左右.
| A. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| B. | 转移溶液前容量瓶内有少量蒸馏水 | |
| C. | 定容时,俯视容量瓶的刻度线 | |
| D. | 定容摇匀时,发现液面降低,又补加少量水,重新达到刻度线 |
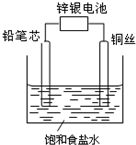 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: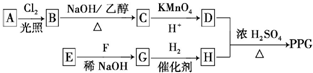
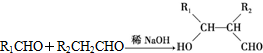

 .
. .
. .
.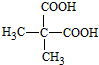
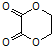 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.