题目内容
2.①用双线桥表示下列氧化还原反应电子转移2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
②配平下列氧化还原反应方程式:
2KMnO4+5H2O2+3H2SO4-1K2SO4+2MnSO4+5 O2↑+8H2O.
分析 ①2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O方程中+7价锰元素化合价降为+2价,-1价氯元素化合价升高为0价,参加反应的氯化氢有16mol,只有10mol化合价升高,据此解答;
②反应中高锰酸钾中+7价锰元素化合价降为硫酸锰中+2价,过氧化氢中-1价氧化化合价升高为氧气中0价氧,依据氧化还原反应得失电子守恒、原子个数守恒写出反应方程式.
解答 解:①2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O方程中+7价锰元素化合价降为+2价,-1价氯元素化合价升高为0价,参加反应的氯化氢有16mol,只有10mol化合价升高,用双线桥表示为: ,
,
故答案为: ;
;
②反应中高锰酸钾中+7价锰元素化合价降为硫酸锰中+2价,过氧化氢中-1价氧化化合价升高为氧气中0价氧,要使得失电子守恒则两者的最小公倍数为10,所以高锰酸钾前面的系数为2,过氧化氢前面的系数为5,然后根据物料守恒得其它物质前面的系数,方程式为:2KMnO4+5H2O2+3H2SO4-1K2SO4+2MnSO4+5O2↑+8H2O;
故答案为:2;5;3;1;2;5;8.
点评 本题考查氧化还原反应的双线桥表示、氧化还原反应的配平,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合价的变化,能会用双线桥法表示电子转移的方向和数目,难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
13.能够鉴定溴乙烷中存在溴元素的实验操作是( )
| A. | 在溴乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| D. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 |
10.下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是( )
| A. | 地下钢管连接锌板 | B. | 汽水底盘喷涂高分子膜 | ||
| C. | 铁件镀铜 | D. | 金属护拦表面涂漆 |
17.研究表明丰富的CO2完全可以作为新能源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气.图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.
①能判断该反应向正反应方向进行的是:B
A.v正(H2)=3v逆(CH3OH)
B.容器中混合气体的密度变大
C.容器中压强不变
D.2个C=O断裂的同时有6个H-H形成
②上述反应其他条件保持不变,在恒容条件下进行,平衡时H2的转化率将变小(填“变大”“变小”或“不变”)
③写出上述反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ•mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下三组数据:
①该反应的△H< 0(填“<”“>”或“=”)
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值:$\frac{1}{6}$(填具体值或取值范围)
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为2mol,则此时v正<v逆(填“<”“>”或“=”)
(3)甲醇在一定条件下能转化为甲醛,碘量滴定法是测定甲醛的化学方法之一,其原理是在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,后将溶液中游离的甲醛氧化为甲酸钠,经适当酸化后,剩余的次碘酸钠和碘化钠又生成碘,上述过程中甲醛参与的化学反应的离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气.图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.
①能判断该反应向正反应方向进行的是:B
A.v正(H2)=3v逆(CH3OH)

B.容器中混合气体的密度变大
C.容器中压强不变
D.2个C=O断裂的同时有6个H-H形成
②上述反应其他条件保持不变,在恒容条件下进行,平衡时H2的转化率将变小(填“变大”“变小”或“不变”)
③写出上述反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ•mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值:$\frac{1}{6}$(填具体值或取值范围)
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为2mol,则此时v正<v逆(填“<”“>”或“=”)
(3)甲醇在一定条件下能转化为甲醛,碘量滴定法是测定甲醛的化学方法之一,其原理是在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,后将溶液中游离的甲醛氧化为甲酸钠,经适当酸化后,剩余的次碘酸钠和碘化钠又生成碘,上述过程中甲醛参与的化学反应的离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O.
7.下列关于物质的用途,叙述不正确的是( )
| A. | 氧化铝熔点高达2045℃,可用于制成坩埚熔化氢氧化钠固体 | |
| B. | HF可以用于刻蚀玻璃 | |
| C. | 镁铝合金可用作制造飞机的材料 | |
| D. | 过氧化钠可用作供氧剂 |
14.实验室用乙酸和正丁醇制备乙酸正丁醇,其反应方程式为CH3COOH+CH3CH3CH2CH2OH $\stackrel{浓硫酸}{?}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据和信息如下:
(1)醇可发生分子间脱水生成醚,如2CH3CH2OH $?_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
(2)醇可发生分子内脱水生成烯烃,如C2H5OH$?_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
请回答有关问题
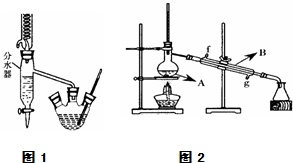
Ⅰ.乙酸正丁酯粗产品的制备
在三孔圆底烧瓶中装入沸石,加入18.5mL正丁醇和15.4mL冰醋酸(稍过量),再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)三孔烧瓶和蒸馏烧瓶在加热时都需要加入沸石,加入沸石是作用是防暴沸.本实验过程中可能产生多种有机副产品,请写成其中一种的结构简式CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3.
(2)反应时加热有利于提高酯的产率,但实验发现温度过高酯的产率反而降低,可能的原因是乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
Ⅱ.乙酸正丁酯粗产品的精制.
(3)将三孔圆底烧瓶中的产物转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,接下来进行的操作名称是分液.
(4)将酯层采用如图2所示装置蒸馏.
①图2中仪器B的名称为冷凝管,水的流向应该从g(“f”或“g”)口进入.
②蒸馏收集乙酸正丁酯粗产品时,应将温度控制在126.1℃左右.
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(2)醇可发生分子内脱水生成烯烃,如C2H5OH$?_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
请回答有关问题

Ⅰ.乙酸正丁酯粗产品的制备
在三孔圆底烧瓶中装入沸石,加入18.5mL正丁醇和15.4mL冰醋酸(稍过量),再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)三孔烧瓶和蒸馏烧瓶在加热时都需要加入沸石,加入沸石是作用是防暴沸.本实验过程中可能产生多种有机副产品,请写成其中一种的结构简式CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3.
(2)反应时加热有利于提高酯的产率,但实验发现温度过高酯的产率反而降低,可能的原因是乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
Ⅱ.乙酸正丁酯粗产品的精制.
(3)将三孔圆底烧瓶中的产物转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,接下来进行的操作名称是分液.
(4)将酯层采用如图2所示装置蒸馏.
①图2中仪器B的名称为冷凝管,水的流向应该从g(“f”或“g”)口进入.
②蒸馏收集乙酸正丁酯粗产品时,应将温度控制在126.1℃左右.