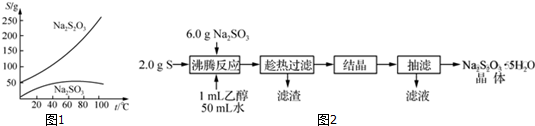
题目内容
6.(1)如图1所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕黄色固体聚集;F中盛放NaOH溶液,是吸收多余气体的吸收装置.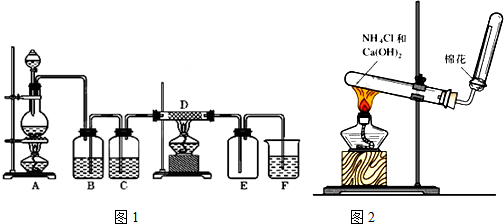
①上述装置中有一处明显错误,请指出是B处(用字母表示).
②实验室用二氧化锰和浓盐酸加热制氯气,写出A中反应的化学方程式MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O.
③B中盛放饱和食盐水,其作用是除去Cl2中的HCl.
④写出D中发生反应的化学方程式3Cl2+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(2)图2是实验室制氨气的装置图,请回答:
①写出实验室制氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
②干燥氨气的干燥剂通常用碱石灰.
③如何检验氨气是否收集满:用湿润的红色石蕊试纸置于收集气体的试管口,试纸变蓝,则收满.
分析 (1)①根据气体流向可知,B装置中导管应是长进短出;
②二氧化锰和浓盐酸加热生成氯气、氯化锰与水;
③制备的氯气中含有HCl,需要吸收除去;
④D中是氯气氯气与Fe反应生成氯化铁;
(2)①实验室用氢氧化钙与氯化铵在加热条件下制备氨气,反应生成氯化钙、氨气与水;
②干燥氨气的干燥剂通常用碱石灰;
③氨气能使湿润的红色石蕊试纸变蓝.
解答 解:(1)①根据气体流向可知,装置图中B错误,B装置中导管应是长进短出,
故答案为:B;
②二氧化锰和浓盐酸加热生成氯气、氯化锰与水,反应方程式为:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O,
故答案为:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O;
③盐酸易挥发,制备的氯气中含有HCl,用饱和食盐水除去Cl2中的HCl,
故答案为:除去Cl2中的HCl;
④D中是氯气氯气与Fe反应生成氯化铁,反应方程式为:3Cl2+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,
故答案为:3Cl2+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(2)①实验室用氢氧化钙与氯化铵在加热条件下制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②干燥氨气的干燥剂通常用碱石灰,故答案为:碱石灰;
③检验氨气是否收集满的方法:用湿润的红色石蕊试纸置于收集气体的试管口,试纸变蓝,则收满,
故答案为:用湿润的红色石蕊试纸置于收集气体的试管口,试纸变蓝,则收满.
氨气能使湿润的红色石蕊试纸变蓝.
点评 本题考查物质制备实验,涉及氯气与氨气的制备、气体检验、对装置的分析评价等,掌握常见气体制备,一般有发生装置、净化装置、收集装置、尾气处理装置等.

| A. | 等体积等物质的量浓度的Na2CO3和Na2SO4溶液,Na2SO4溶液中的离子总数多于Na2CO3溶液 | |
| B. | 相同温度下,pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液:c(NaClO)>c(NaHCO3)>c(NaOH) | |
| C. | 常温下,CH3COONa与HCl溶液混合所得中性溶液:c(Na+)=c(Cl-)>c(H+)=c(OH一) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气.图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.
①能判断该反应向正反应方向进行的是:B
A.v正(H2)=3v逆(CH3OH)

B.容器中混合气体的密度变大
C.容器中压强不变
D.2个C=O断裂的同时有6个H-H形成
②上述反应其他条件保持不变,在恒容条件下进行,平衡时H2的转化率将变小(填“变大”“变小”或“不变”)
③写出上述反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ•mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值:$\frac{1}{6}$(填具体值或取值范围)
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为2mol,则此时v正<v逆(填“<”“>”或“=”)
(3)甲醇在一定条件下能转化为甲醛,碘量滴定法是测定甲醛的化学方法之一,其原理是在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,后将溶液中游离的甲醛氧化为甲酸钠,经适当酸化后,剩余的次碘酸钠和碘化钠又生成碘,上述过程中甲醛参与的化学反应的离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O.
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(2)醇可发生分子内脱水生成烯烃,如C2H5OH$?_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
请回答有关问题
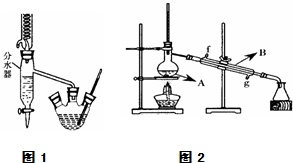
Ⅰ.乙酸正丁酯粗产品的制备
在三孔圆底烧瓶中装入沸石,加入18.5mL正丁醇和15.4mL冰醋酸(稍过量),再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)三孔烧瓶和蒸馏烧瓶在加热时都需要加入沸石,加入沸石是作用是防暴沸.本实验过程中可能产生多种有机副产品,请写成其中一种的结构简式CH3CH2CH2CH2OCH2CH2CH2CH3或CH2=CHCH2CH3.
(2)反应时加热有利于提高酯的产率,但实验发现温度过高酯的产率反而降低,可能的原因是乙酸、正丁醇都易挥发,温度过高可能使乙酸、正丁醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
Ⅱ.乙酸正丁酯粗产品的精制.
(3)将三孔圆底烧瓶中的产物转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,接下来进行的操作名称是分液.
(4)将酯层采用如图2所示装置蒸馏.
①图2中仪器B的名称为冷凝管,水的流向应该从g(“f”或“g”)口进入.
②蒸馏收集乙酸正丁酯粗产品时,应将温度控制在126.1℃左右.
| A. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| B. | 转移溶液前容量瓶内有少量蒸馏水 | |
| C. | 定容时,俯视容量瓶的刻度线 | |
| D. | 定容摇匀时,发现液面降低,又补加少量水,重新达到刻度线 |
 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: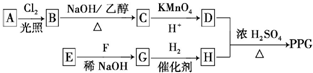
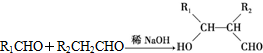

 .
. .
. .
.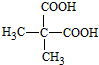
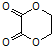 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.