题目内容
8.用下列气体和溶液进行喷泉实验,最终液体不能充满烧瓶的是( )| A. | CO2和NaOH溶液 | B. | NH3和稀盐酸 | C. | NO2和水 | D. | SO2和NaOH溶液 |
分析 喷泉实验的形成原理是气体极易溶于水(或溶液)或与水(或溶液)发生反应而导致容器压强减小,形成负压差,从而形成喷泉,据此分析解答.
解答 解:A.二氧化碳与氢氧化钠反应,被氢氧化钠吸收,形成负压差,可以产生喷泉实验,且最终无气体剩余,液体能充满烧瓶.故A不选;
B.氨气与稀盐酸反应生成氯化铵,且最终无气体剩余,液体能充满烧瓶,能产生喷泉,故B不选;
C.二氧化氮与水反应,被水溶液吸收,形成负压差,可以产生喷泉实验,但是同时生成了NO,烧瓶内有气体剩余,液体不能充满烧瓶,故C选;
D.二氧化硫为酸性氧化物,能够与氢氧化钠反应,被氢氧化钠吸收,形成负压差,可以产生喷泉实验,且最终无气体剩余,液体能充满烧瓶,故D不选;故选C.
点评 本题考查了喷泉实验,明确喷泉实验的原理和常见气体的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
8.M(C3H6O2)、N(C4H10O)与W(C7H14O2)之间的转化关系为M+N$?_{△}^{H_{2}SO_{4}}$W+H20(已配平),下列说法不正确的是( )
| A. | W有4种不同结构(不考虑立体异构) | |
| B. | M分子中的3个C原子一定在同一平面上 | |
| C. | M、N、W均可发生氧化反应、还原反应和取代反应 | |
| D. | 若N中的O原子为18O,则上述反应充分进行后,所得混合物中N和W均含有18O |
16.下列说法正确的是( )
| A. | 等体积等物质的量浓度的Na2CO3和Na2SO4溶液,Na2SO4溶液中的离子总数多于Na2CO3溶液 | |
| B. | 相同温度下,pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液:c(NaClO)>c(NaHCO3)>c(NaOH) | |
| C. | 常温下,CH3COONa与HCl溶液混合所得中性溶液:c(Na+)=c(Cl-)>c(H+)=c(OH一) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
13.能够鉴定溴乙烷中存在溴元素的实验操作是( )
| A. | 在溴乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| D. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 |
17.研究表明丰富的CO2完全可以作为新能源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气.图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.
①能判断该反应向正反应方向进行的是:B
A.v正(H2)=3v逆(CH3OH)
B.容器中混合气体的密度变大
C.容器中压强不变
D.2个C=O断裂的同时有6个H-H形成
②上述反应其他条件保持不变,在恒容条件下进行,平衡时H2的转化率将变小(填“变大”“变小”或“不变”)
③写出上述反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ•mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下三组数据:
①该反应的△H< 0(填“<”“>”或“=”)
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值:$\frac{1}{6}$(填具体值或取值范围)
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为2mol,则此时v正<v逆(填“<”“>”或“=”)
(3)甲醇在一定条件下能转化为甲醛,碘量滴定法是测定甲醛的化学方法之一,其原理是在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,后将溶液中游离的甲醛氧化为甲酸钠,经适当酸化后,剩余的次碘酸钠和碘化钠又生成碘,上述过程中甲醛参与的化学反应的离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O.
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气.图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.
①能判断该反应向正反应方向进行的是:B
A.v正(H2)=3v逆(CH3OH)

B.容器中混合气体的密度变大
C.容器中压强不变
D.2个C=O断裂的同时有6个H-H形成
②上述反应其他条件保持不变,在恒容条件下进行,平衡时H2的转化率将变小(填“变大”“变小”或“不变”)
③写出上述反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ•mol-1
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)═CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值:$\frac{1}{6}$(填具体值或取值范围)
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为2mol,则此时v正<v逆(填“<”“>”或“=”)
(3)甲醇在一定条件下能转化为甲醛,碘量滴定法是测定甲醛的化学方法之一,其原理是在碱性介质(NaOH)中,碘转化为次碘酸钠和碘化钠,后将溶液中游离的甲醛氧化为甲酸钠,经适当酸化后,剩余的次碘酸钠和碘化钠又生成碘,上述过程中甲醛参与的化学反应的离子方程式为:HCHO+IO-+OH-=HCOO-+I-+H2O.
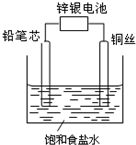 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: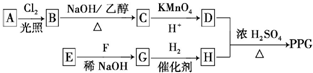
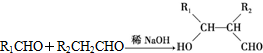

 .
. .
. .
.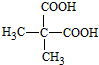
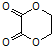 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.