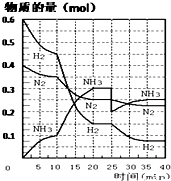
题目内容
18.现有A、B、C、D 4种元素,前3种元素的离子都和氖原子具有相同的核外电子排布.A元素没有正化合价;B的氢化物分子式为H2B,0.2mol的C单质能从酸中置换出2.24L H2(标准状况).D的原子核中没有中子.(1)根据以上条件,推断A、B、C、D的元素名称:
A氟 B氧 C钠 D氢
(2)用电子式表示C与A、B与D相互结合成的化合物,指出其化合物的类型及化学键类型
C+A电子式
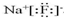 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键.B+D电子式
 ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键.(3)用电子式表示B、C两元素形成化合物的过程
 或
或 .
.
分析 A、B、C、D4种元素,前3种元素的离子结构都和氖原子具有相同的核外电子排布,0.2mol的C原子能从酸中置换产生2.24L H2(标况下),则C为金属,其化合价=$\frac{\frac{2.24L}{22.4L/mol}}{0.2mol}$=1,可推知C为Na;D的原子核中没有中子,则D为H元素;A没有正价态的化合物,B和D可形成的D2B分子,则A为F元素、B为O元素,据此解答.
解答 解:A、B、C、D4种元素,前3种元素的离子结构都和氖原子具有相同的核外电子排布,0.2mol的C原子能从酸中置换产生2.24L H2(标况下),则C为金属,其化合价=$\frac{\frac{2.24L}{22.4L/mol}}{0.2mol}$=1,可推知C为Na;D的原子核中没有中子,则D为H元素;A没有正价态的化合物,B和D可形成的D2B分子,则A为F元素、B为O元素.
(1)由上述分析可知,A为氟元素,B为氧元素,C为钠,D为氢元素,故答案为:氟;氧;钠;氢;
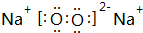
(2)C与A形成的化合物为NaF,电子式为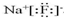 ,属于离子化合物,含有离子键,
,属于离子化合物,含有离子键,
B与D形成的化合物为 等,属于共价化合物,含有共价键,
等,属于共价化合物,含有共价键,
故答案为: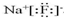 ,离子化合物,离子键;
,离子化合物,离子键; ,共价化合物,共价键;
,共价化合物,共价键;
(3)B、C两元素形成化合物为氧化钠、过氧化钠,用电子式表示形成过程: 或
或 ,
,
故答案为: 或
或 .
.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,注意理解掌握用电子式表示化学键或物质的形成.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
20.下列物质的性质与应用对应关系错误的是( )
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
9.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如表(所取溶液体积均为5mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择①④(填实验编号).
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
13.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)=H2(g)+I2(g)若c(HI) 由0.1mol/L
降到0.07mol/L时,需要15s,那么c(HI)由0.07mol/L降到0.05mol/L时,所需反应时间为( )
降到0.07mol/L时,需要15s,那么c(HI)由0.07mol/L降到0.05mol/L时,所需反应时间为( )
| A. | 等于5s | B. | 等于10s | C. | 大于10s | D. | 小于10s |
7.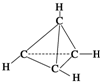 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
 (写一种);
(写一种);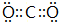 (写一种).
(写一种).