题目内容
3.合成氨反应原理为:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol.在500℃,20MPa时,将N2和H2通入到一定体积的密闭容器中,反应过程中各物质的物质的量变化如图所示: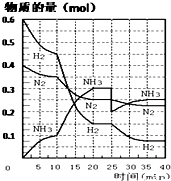
(1)在10~20min内NH3浓度变化的原因可能是a(填字母).
a.加了催化剂 b.降低温度c.增加NH3物质的量
(2)该可逆反应达到平衡的标志是ce(填字母).
a.a mol N≡N键断裂的同时,有6a mol N-H键合成
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d.N2、H2、NH3的分子数之比为1:3:2
e.单位时间生成m mol N2的同时消耗3m mol H2
(3)在反应进行到25min时,曲线发生变化的原因是移走了生成的氨气(或减小了氨气的浓度).
(4)据报道,一定条件下甲烷还原Fe2O3得到的“纳米级”金属铁,可用作合成氨反应的催化剂.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g) 该反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少48g.则
该段时间内H2的平均反应速率为0.18mol•(L•min)-1.
分析 (1)根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
(2)反应N2(g)+3H2(g)=2NH3
a.a mol N≡N键断裂的同时,有6a mol N-H键形成,方向相同,不能作为平衡的判断,故错误;
b.混合气体的质量不变,气体的物质的量变化,故密度为变量,若密度不再随时间变化,说明平衡,故正确;
c.容器内前后气体的物质的量有变化,说明压强时变量,总压强不再随时间而变化,说明平衡,故正确;
d.N2、H2、NH3的分子数之比为1:3:2任何时刻都成立,故错误;
e.单位时间生成m mol N2的同时消耗3m mol H2,方向相反成正比例,故正确;
(3)25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;
(4)n(Fe2O3)=$\frac{48g}{160g/mol}$=0.3mol,根据方程式知,有0.3mol氧化铁参加反应时有1.8mol氢气生成,根据v=$\frac{\frac{△n}{V}}{△t}$计算该段时间内氢气平均反应速率.
解答 解:(1)由图可知,0-10分钟内△n(N2)=0.025mol×2=0.05mol;10-20分钟内△n′(N2)=0.025mol×4=0.1mol,速率之比等于物质的量之比,所以,0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;由图象可知各组分物质的量变化增快,且10min时变化是连续的,20min达平衡时,△n′(N2)=0.025mol×4=0.1mol,△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,故答案为:a;
(2)反应N2(g)+3H2(g)=2NH3
a.a mol N≡N键断裂的同时,有6a mol N-H键形成,方向相同,不能作为平衡的判断,故错误;
b.混合气体的质量不变,气体的体积不变,故密度不变,若密度不再随时间变化,不能说明平衡,故错误;
c.容器内前后气体的物质的量有变化,说明压强时变量,总压强不再随时间而变化,说明平衡,故正确;
d.N2、H2、NH3的分子数之比为1:3:2任何时刻都成立,故错误;
e.单位时间生成m mol N2的同时消耗3m mol H2,方向相反成正比例,故正确;
故答案为:ce;
(3)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,故答案为:移走了生成的氨气(或减小了氨气的浓度);
(4)n(Fe2O3)=$\frac{48g}{160g/mol}$=0.3mol,根据方程式知,有0.3mol氧化铁参加反应时有1.8mol氢气生成,根据v=$\frac{\frac{△n}{V}}{△t}$,v(H2)=$\frac{\frac{1.8mol}{5L}}{2min}$═0.18mol•(L•min)-1,
故答案为:0.18mol•(L•min)-1.
点评 本题考查化学反应速率、化学平衡的计算、平衡移动以及平衡状态的判断,题目难度中等,注意对图象的分析.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}/高温}{→}$SiCl4$\stackrel{H_{2}/高温}{→}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg |
| A. | 正反应速率与逆反应速率相等且为零 | |
| B. | A、B、C的浓度不再变化 | |
| C. | A、B、C的物质的量相等 | |
| D. | A、B、C的分子数目比为1:3:2 |
| A. | 11:1 | B. | 9:1 | C. | 1:11 | D. | 2:9 |
【实验一】实验步骤如下:
| 实验序号 | 实验步骤 |
| ① | 向新制的Na2S溶液中滴加新制的氯水 |
| ② | 将镁条投入1mol/L的稀盐酸中 |
| ③ | 将铝条投入1mol/L的稀盐酸中 |
(2)实验①的现象是生成浅黄色沉淀,反应的化学方程式是Cl2+Na2S=S↓+2NaCl.
【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.
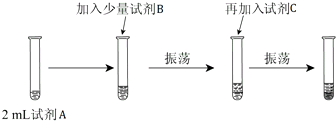
(3)试剂A是NaBr溶液;试剂B是氯水;试剂C是四氯化碳.
(4)试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,
加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色.
以上反应可以证明Cl2的非金属性强于(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2.
| A. | 常温下都不可用铝制容器贮存 | |
| B. | 常温下都能与铜较快反应 | |
| C. | 露置于空气中,溶液浓度均降低 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
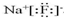 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键.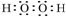 ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键. 或
或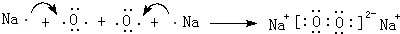 .
.