题目内容
6.五种短周期元素A、B、C、D、E,原子序数依次增大,其中A、B同周期,且A、B原子核外均有两个未成对电子;A、D同主族,B、E同主族,且C的最外层电子比E的最外层电子少5个.根据以上信息,完成下列各题:(1)五种元素原子的电负性由小到大的顺序为Na<Si<C<S<O(用元素符号表示);B的氢化物的沸点>E氢化物的沸点(填“>”或“<”),原因是水分子间存在氢键.
(2)选取上述五种元素,完成下列问题
①含有非极性键的离子化合物的电子式
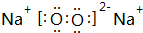 (写一种);
(写一种);②含有极性键的非极性分子的电子式
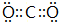 (写一种).
(写一种).
分析 五种短周期元素A、B、C、D、E,原子序数依次增大,B、E同主族,则B处于第二周期、E处于第三周期,而A、B同周期,且A、B原子核外均有两个未成对电子,则A、B外围电子排布式分别为2s22p2、2s22p4,故A为碳元素、B为O元素,可推知E为S元素;A、D同主族,D的原子序数大于氧,故D为Na;C的最外层电子比E的最外层电子少5个,C最外层电子数为4,原子序数大于氧,故C为Si.
解答 解:五种短周期元素A、B、C、D、E,原子序数依次增大,B、E同主族,则B处于第二周期、E处于第三周期,而A、B同周期,且A、B原子核外均有两个未成对电子,则A、B外围电子排布式分别为2s22p2、2s22p4,故A为碳元素、B为O元素,可推知E为S元素;A、D同主族,D的原子序数大于氧,故D为Na;C的最外层电子比E的最外层电子少5个,C最外层电子数为4,原子序数大于氧,故C为Si.
(1)非金属性越强,电负性越大,故电负性:Na<Si<C<S<O,
B、E的氢化物分别为H2O、H2S,水分子之间形成氢键,而硫化氢不能,故水的沸点高于硫化氢的,
故答案为:Na<Si<C<S<O;>;水分子间存在氢键;
(2)①含有非极性键的离子化合物为Na2O2等,电子式为 ,
,
故答案为: ;
;
②含有极性键的非极性分子为CO2等,电子式为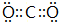 ,
,
故答案为: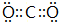 .
.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、电负性、氢键、电子式等,注意氢键对物质性质的影响.

练习册系列答案
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
14.在一定温度下,下列叙述是可逆反应A(g)+3B(g)?2C(g)达到平衡的标志的是( )
| A. | 正反应速率与逆反应速率相等且为零 | |
| B. | A、B、C的浓度不再变化 | |
| C. | A、B、C的物质的量相等 | |
| D. | A、B、C的分子数目比为1:3:2 |
1.下列说法中正确的是( )
| A. | 原电池中阴离子向正极移动 | |
| B. | 原电池是将电能转化为化学能的装置 | |
| C. | 原电池中电子流出的极为负极,发生氧化反应 | |
| D. | 原电池正极上发生氧化反应 |
16.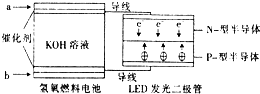 LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
 LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | P-型半导体连接的是电池负极 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | a处通入氢气,发生还原反应 | |
| D. | 该装置中只涉及两种形式的能量转化 |
 .
. .
. .
.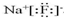 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键.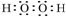 ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键. 或
或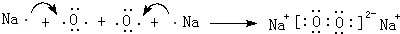 .
.