题目内容
13.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)=H2(g)+I2(g)若c(HI) 由0.1mol/L降到0.07mol/L时,需要15s,那么c(HI)由0.07mol/L降到0.05mol/L时,所需反应时间为( )
| A. | 等于5s | B. | 等于10s | C. | 大于10s | D. | 小于10s |
分析 若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,当速率与浓度变化成正比时,需要10s,但浓度越小,化学反应速率越小,需要的时间就长,以此来解答.
解答 解:若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;
c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,
当速率与浓度变化成正比时,需要$\frac{0.02mol/L}{0.03mol/L}$×15s=10s,
但浓度越小,化学反应速率越小,需要的时间就长,
所以需要时间大于10s,
故选C.
点评 本题考查了化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意浓度越大反应速率越大是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
1.下列说法中正确的是( )
| A. | 原电池中阴离子向正极移动 | |
| B. | 原电池是将电能转化为化学能的装置 | |
| C. | 原电池中电子流出的极为负极,发生氧化反应 | |
| D. | 原电池正极上发生氧化反应 |
3.如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述错误的是( )
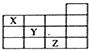

| A. | X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 | |
| B. | 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z | |
| C. | Z的单质常温下是液体,可与铁粉反应 | |
| D. | Z的原子序数比Y大9 |
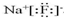 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键.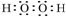 ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键. 或
或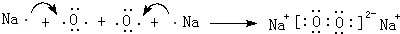 .
.