题目内容
20.下列物质的性质与应用对应关系错误的是( )| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
分析 A.二氧化氯中Cl元素 化合价为+4价,具有强氧化性;
B.氢氧化铝是两性氢氧化物和酸碱发生反应;
C.石英主要成分为二氧化硅,熔点高;
D.钠钾合金呈液态,具有良好的导热性.
解答 解:A.二氧化氯中Cl元素 化合价为+4价,具有强氧化性,可用于杀菌消毒,故A正确;
B.氢氧化铝具有弱酸性、弱碱性,和胃酸中盐酸反应,可用于治疗胃酸过多,故B正确;
C.二氧化硅熔点高可用于制作石英坩埚,故C正确;
D.钠钾合金呈液态,具有良好的导热、导电性质,可以做中子反应堆作热交换剂,故D错误;
故选D.
点评 本题考查了物质性质,主要是物质的性质应用,注意知识的积累和掌握,题目较简单.

练习册系列答案
相关题目
5.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}/高温}{→}$SiCl4$\stackrel{H_{2}/高温}{→}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg |

 .
.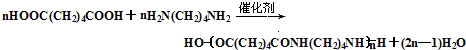 .
.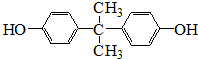 .
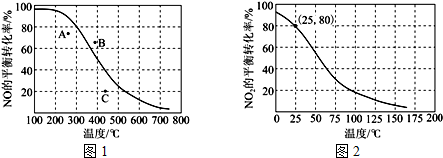
.
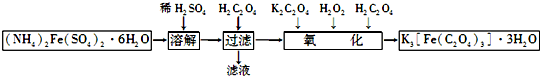
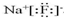 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键. ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键. 或
或 .
.