题目内容
7.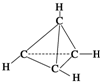 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 图示结构为正四面体形结构,一卤代烃、二卤代烃、三卤代烃、四卤代烃各有一种.
解答 解:图示结构为正四面体形结构,一卤代烃、二卤代烃、三卤代烃、四卤代烃各有一种.由于C4H4与Cl2在光照条件下发生取代反应,生成C4H3Cl、C4H2Cl2、C4HCl3、C4Cl4和HCl,由C4H4中的4个C原子构成正四面体知,C4H3Cl、C4H2Cl2、C4HCl3、C4Cl4的结构都只有一种,所以C4H4与Cl2发生取代反应生成的卤代烃的种类共有4种.
故选B.
点评 本题考查同分异构体的书写,会确定等效氢原子是解本题的关键.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
12.下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
【实验一】实验步骤如下:
(1)设计该实验方案的目的是:探究同周期元素的性质(或金属性与非金属性)的递变规律.
(2)实验①的现象是生成浅黄色沉淀,反应的化学方程式是Cl2+Na2S=S↓+2NaCl.
【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.
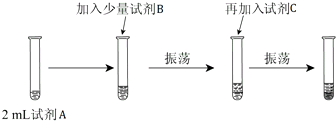
(3)试剂A是NaBr溶液;试剂B是氯水;试剂C是四氯化碳.
(4)试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,
加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色.
以上反应可以证明Cl2的非金属性强于(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2.
【实验一】实验步骤如下:
| 实验序号 | 实验步骤 |
| ① | 向新制的Na2S溶液中滴加新制的氯水 |
| ② | 将镁条投入1mol/L的稀盐酸中 |
| ③ | 将铝条投入1mol/L的稀盐酸中 |
(2)实验①的现象是生成浅黄色沉淀,反应的化学方程式是Cl2+Na2S=S↓+2NaCl.
【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.

(3)试剂A是NaBr溶液;试剂B是氯水;试剂C是四氯化碳.
(4)试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,
加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色.
以上反应可以证明Cl2的非金属性强于(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2.
16. LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
 LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | P-型半导体连接的是电池负极 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | a处通入氢气,发生还原反应 | |
| D. | 该装置中只涉及两种形式的能量转化 |
17.下列化学用语书写正确的是( )
| A. | 作为相对原子质量标准的原子${\;}_{6}^{14}$C | |
| B. | 氯化镁的电子式: | |
| C. | 用电子式表示氯化氢分子的形成过程: | |
| D. | HClO的结构式为:H-Cl-O |
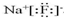 ,化合物类型:离子化合物,化学键类型:离子键.
,化合物类型:离子化合物,化学键类型:离子键. ,化合物类型:共价化合物,化学键类型:共价键.
,化合物类型:共价化合物,化学键类型:共价键. 或
或 .
.