题目内容
10.下列反应的离子方程式正确的是( )| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入盐酸Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片加入稀硝酸中3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20 | |
| D. | 小苏打溶液和盐酸混合CO32-+2H+═CO2↑+H2O |
分析 A.醋酸在离子反应中保留化学式;
B.反应生成氯化钙和水,石灰水完全电离;
C.反应生成硝酸铜、NO和水;
D.小苏打为碳酸氢钠.
解答 解:A.碳酸钙溶于醋酸的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O,故A错误;
B.澄清石灰水中加入盐酸的离子反应为OH-+H+═H2O,故B错误;
C.铜片加入稀硝酸中的离子反应为3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20,故C正确;
D.小苏打溶液和盐酸混合的离子反应为HCO3-+H+═CO2↑+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.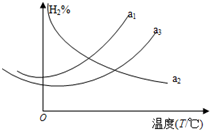 利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g)?催化剂CH3OH(g)△H1
Ⅱ.CO2(g)+H2(g)?催化剂CO(g)+H2O(g)△H2
Ⅲ.CO2(g)+3H2(g)?催化剂CH3OH(g)+H2O(g)△H3
(1)上述反应达到平衡时对应的氢气的百分含量分别为a1、a2、a3,它们随温度变化的曲线如图所示.则△H2> (填“>”、“<”或“=”) 0,判断理由是升温平衡向吸热反应方向进行;△H1<△H3(填“>”、“<”或“=”).
(2)在温度T时,向某容器中充入1mol CO2和3mol H2,发生反应Ⅲ的反应.
①如果该容器为恒压容器,维持体系总压强p恒定,达到平衡时,已知H2的转化率为75%,则在该温度下平衡常数Kp=$\frac{100{P}^{2}}{3}$(用平衡分压代替平衡浓度计算,
分压=总压×物质的量分数).
②如果该容器为恒容容器,达到平衡时,H2的转化率<(填“>”、“<”或“=”)75%,理由是恒容容器中,达到平衡时体系压强比恒压容器中小.
(3)在2.0L密闭容器中放入1molCO2(g)和1molH2(g),在一定温度下发生反应Ⅱ的反应,2小时后达到平衡.下表为c(CO2)与反应时间的数据:
40min时,用CO2表示的该反应速率为0.008mol/L•min,分析该反应过程中c(CO2)变化与时间间隔(△t)的规律,得出的结论是随时间增加,二氧化碳浓度减少,反应速率减小.
 利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:Ⅰ.CO(g)+2H2(g)?催化剂CH3OH(g)△H1
Ⅱ.CO2(g)+H2(g)?催化剂CO(g)+H2O(g)△H2
Ⅲ.CO2(g)+3H2(g)?催化剂CH3OH(g)+H2O(g)△H3
(1)上述反应达到平衡时对应的氢气的百分含量分别为a1、a2、a3,它们随温度变化的曲线如图所示.则△H2> (填“>”、“<”或“=”) 0,判断理由是升温平衡向吸热反应方向进行;△H1<△H3(填“>”、“<”或“=”).
(2)在温度T时,向某容器中充入1mol CO2和3mol H2,发生反应Ⅲ的反应.
①如果该容器为恒压容器,维持体系总压强p恒定,达到平衡时,已知H2的转化率为75%,则在该温度下平衡常数Kp=$\frac{100{P}^{2}}{3}$(用平衡分压代替平衡浓度计算,
分压=总压×物质的量分数).
②如果该容器为恒容容器,达到平衡时,H2的转化率<(填“>”、“<”或“=”)75%,理由是恒容容器中,达到平衡时体系压强比恒压容器中小.
(3)在2.0L密闭容器中放入1molCO2(g)和1molH2(g),在一定温度下发生反应Ⅱ的反应,2小时后达到平衡.下表为c(CO2)与反应时间的数据:
| 反应时间t/min | 20 | 40 | 60 | 80 |
| c(CO2)(mol/L) | 0.300 | 0.180 | 0.109 | 0.066 |
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )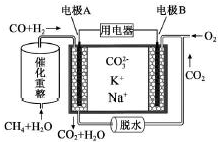

| A. | 正极产物为CO2 | |
| B. | 负极电极反应式为CO-2e-+CO32-═2CO2 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电池总反应式为CO+H2+O2═2CO2+H2O |
20.比较下列物质的稳定性,正确的是( )
| A. | Na2O>Na2O2 | B. | Na2CO3>NaHCO3>H2CO3 | ||
| C. | Na2SO4•10H2O>Na2CO3•10H2O | D. | NaClO>NaCl>NaF |
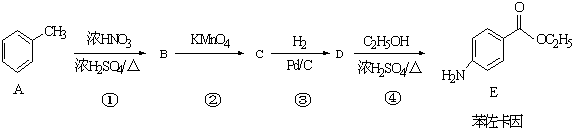
 .
. +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$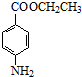 +H2O
+H2O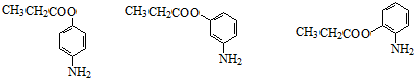 (其中一种)(任写一种)
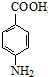
(其中一种)(任写一种) )的合成路线图(其他原料任选).
)的合成路线图(其他原料任选).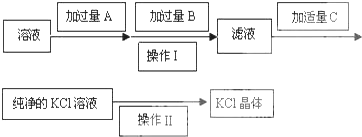
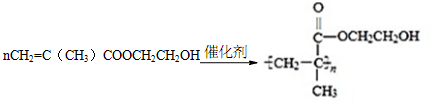 .
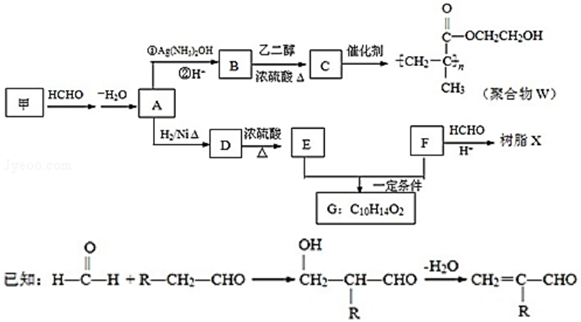
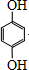
.
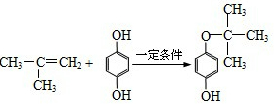 ,反应类型是加成反应.
,反应类型是加成反应.