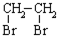题目内容
18.25℃时,H2O的离子积常数为1×10-14 mol2•L-2,则该温度下:①0.01mol•L-1NaOH溶液的pH是多少?
②0.005mol•L-1H2SO4溶液中,水电离出的氢氧根浓度是多少?
分析 ①先计算溶液中c(H+),溶液的pH=-lgc(H+);
②先计算溶液中c(H+),酸或碱抑制水电离,则水电离出的c(OH-)等于溶液中c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$.
解答 解:①溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12 mol/L,溶液的pH=-lgc(H+)=-lg10-12=12,
答:0.01mol•L-1NaOH溶液的pH是12;
②溶液中c(H+)=2c(H2SO4)=0.005mol/L×2=0.01mol/L,酸或碱抑制水电离,则水电离出的c(OH-)等于溶液中c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12 mol/L,
答:0.005mol•L-1H2SO4溶液中,水电离出的氢氧根浓度是10-12 mol/L.
点评 本题考查pH的有关计算,为高频考点,侧重考查学生分析计算能力,注意酸溶液中c(H+)与该溶液中水电离出c(H+)的关系,难点是计算酸溶液中水电离出c(H+).

练习册系列答案
相关题目
5.下列说法中正确的是( )
| A. | 高纯度的单晶硅可用于制造太阳能电池板和光导纤维 | |
| B. | 石油可以通过裂解、裂化等物理变化获得重要化工原料乙烯 | |
| C. | 鸡蛋清和淀粉溶液都属于胶体,遇到硫酸铜溶液可以发生胶体聚沉 | |
| D. | 植物油中由于含有碳碳双键,因此在空气中长时间放置容易氧化变质 |
6.下列关于煤和石油的说法中正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油分馏和煤干馏都是物理变化 | |
| C. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
6.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| C. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol |
3.一定温度时,KW=1×10-12 mol2•L-2,对纯水的叙述正确的是( )
| A. | pH=6,显弱酸性 | B. | [H+]=10-6mo1•L-1,溶液为中性 | ||
| C. | [OH-]=10-6mo1•L-1,溶液为碱性 | D. | 温度不变稀释10倍,pH=7 |
10.下列反应的离子方程式正确的是( )
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入盐酸Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片加入稀硝酸中3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20 | |
| D. | 小苏打溶液和盐酸混合CO32-+2H+═CO2↑+H2O |
7.“细节决定成败”化学实验中尤其要注重细节.下列实验操作或设计正确的是( )
| A. | 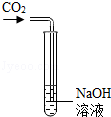 检验生成的气体是CO2 | B. | 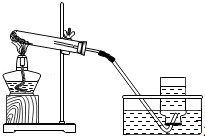 加高锰酸钾制氧气 | ||
| C. | 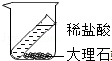 验证质量守恒定律 | D. | 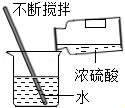 实验室稀释浓硫酸 |
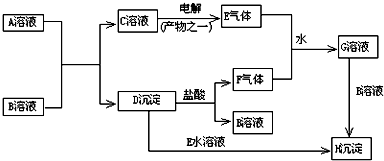
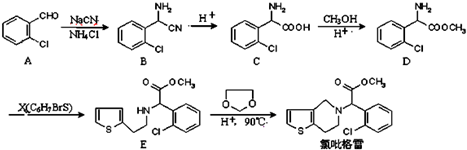
 .
. .
.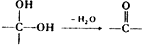 ,
,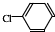 中氯原子较难水解物质A(
中氯原子较难水解物质A(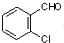 ),可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
),可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式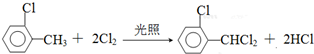 、
、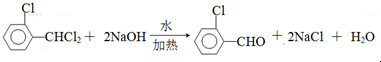 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式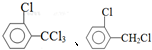 .
.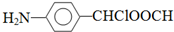 .
.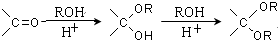 写出由乙烯、甲醇为有机原料制备化合物
写出由乙烯、甲醇为有机原料制备化合物 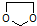 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: