题目内容
20.比较下列物质的稳定性,正确的是( )| A. | Na2O>Na2O2 | B. | Na2CO3>NaHCO3>H2CO3 | ||
| C. | Na2SO4•10H2O>Na2CO3•10H2O | D. | NaClO>NaCl>NaF |
分析 A.氧化钠与氧气加热生成过氧化钠;
B.碳酸钠加热不分解,碳酸氢钠加热分解,碳酸常温下分解;
C.十水碳酸钠比芒硝更容易失去结晶水;
D.次氯酸钠受热分解,氯化钠和氟化钠性质稳定,受热不分解,氟化钠熔点高于氯化钠.
解答 解:A.氧化钠与氧气加热生成过氧化钠,所以稳定性:Na2O<Na2O2,故A错误;
B.碳酸钠加热不分解,碳酸氢钠加热分解,碳酸常温下分解,所以稳定性:Na2CO3>NaHCO3>H2CO3,故B正确;
C.十水碳酸钠比芒硝更容易失去结晶水,所以稳定性:Na2SO4•10H2O>Na2CO3•10H2O,故C正确;
D.次氯酸钠受热分解,氯化钠和氟化钠性质稳定,受热不分解,氟化钠熔点高于氯化钠,所以稳定性:NaClO<NaCl<NaF,故D错误;
故选:BC.
点评 本题考查了物质的性质,熟悉相关物质的热稳定性是解题关键,题目难度不大,注意对相关知识的积累.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
10.下列反应的离子方程式正确的是( )
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入盐酸Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片加入稀硝酸中3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20 | |
| D. | 小苏打溶液和盐酸混合CO32-+2H+═CO2↑+H2O |
15.以NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1300kJ/mol的说法中,正确的是( )
| A. | 当有10NA个电子转移时,该反应放出1300kJ的能量 | |
| B. | 当有10NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| C. | 当有2NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| D. | 当有1NA个水分子生成且为液体时,吸收1300kJ的能量 |
5.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一个水分子的质量为18NA g | |
| B. | 常温常压下,22.4L氯气与足量金属钠充分反应,转移的电子数为2 NA | |
| C. | 1mol•L-1 CaCl2溶液中所含Ca2+离子的数目为NA | |
| D. | 通常状况下,32g 混合气体(O2和O3 )所含的氧原子数一定为2NA |
12.有Fe2+﹑NO3-﹑Fe3+、NH4+﹑H2O 和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A. | 氧化剂与还原剂的物质的量之比为8:1 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,则转移3mol e- | |
| D. | 若把该反应设计为原电池,则负极反应为 Fe2+-e _=Fe3+ |
9.三氯化氮分子中每个原子的最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向氮原子.则下列关于三氯化氮的叙述正确的是( )
| A. | NCl3为非极性分子 | |
| B. | NCl3跟水反应的产物为NH3和HClO | |
| C. | NCl3跟水反应生成NH4Cl、O2和Cl2 | |
| D. | 在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl |
10.下列化学用语书写正确的是( )
| A. | S2-离子的结构示意图: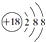 | B. | H2O2的电子式: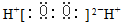 | ||
| C. | CO2的比例模型: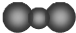 | D. | 有8个质子、10个中子的核素:188O |
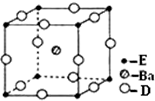 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.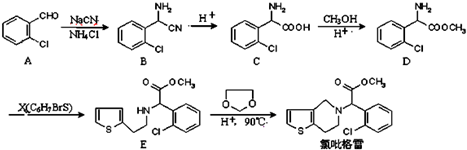
 .
. .
.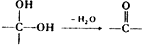 ,
,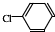 中氯原子较难水解物质A(
中氯原子较难水解物质A(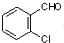 ),可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
),可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式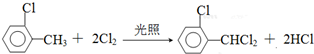 、
、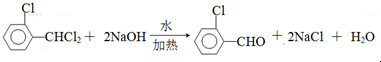 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式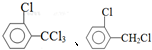 .
.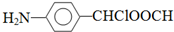 .
.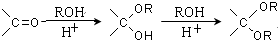 写出由乙烯、甲醇为有机原料制备化合物
写出由乙烯、甲醇为有机原料制备化合物 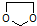 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: