题目内容
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )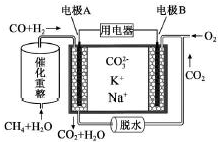
| A. | 正极产物为CO2 | |
| B. | 负极电极反应式为CO-2e-+CO32-═2CO2 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电池总反应式为CO+H2+O2═2CO2+H2O |
分析 原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,正极B上为氧气得电子生成CO32-,以此解答该题.
解答 解:A.A为负极,负极上CO和H2失电子发生了氧化反应,B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故A错误;
B.A为负极,负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,故B错误;
C.电池工作时,阳离子向正极移动,阴离子向负极移动,CO32-向电极A移动,故C正确;
D.电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,B为正极,正极反应为O2+2CO2+4e-=2CO32-,电池总反应式为CO+H2+O2═CO2+H2O,故D错误.
故选C.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
9.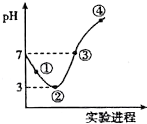 常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
 常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 用pH试纸测①处c(H+)约为②处c (H+)的两倍 | |
| B. | 可依据②处数据计算所溶解的n(Cl2) | |
| C. | ③处表示溶液中,c(Na+)=c(ClO-)+c(Cl-) | |
| D. | 曲线③④段有离子反应:HClO+OH-→ClO-+H2O |
10.下列反应的离子方程式正确的是( )
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入盐酸Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片加入稀硝酸中3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20 | |
| D. | 小苏打溶液和盐酸混合CO32-+2H+═CO2↑+H2O |
17. 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )
 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸的所有原子均在同一平面上 | |
| C. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| D. | 乙酰水杨酸易溶于水、乙醇等溶剂 |
7.“细节决定成败”化学实验中尤其要注重细节.下列实验操作或设计正确的是( )
| A. | 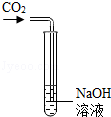 检验生成的气体是CO2 | B. | 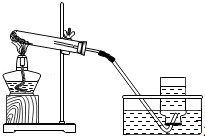 加高锰酸钾制氧气 | ||
| C. | 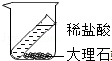 验证质量守恒定律 | D. | 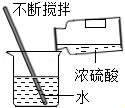 实验室稀释浓硫酸 |
14.室温下,有如下三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A. | 将pH=3 的①溶液与pH=11的②溶液等体积混合,溶液pH>7 | |
| B. | 若三种溶液浓度相同,将溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| C. | 将①、②等浓度体积混合,混合液中c(CH3COO-)+c(CH3COOH)═c(Na+) | |
| D. | 若②、③的pH值相同,则两种溶液中水的电离程度相同 |
12.有Fe2+﹑NO3-﹑Fe3+、NH4+﹑H2O 和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A. | 氧化剂与还原剂的物质的量之比为8:1 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,则转移3mol e- | |
| D. | 若把该反应设计为原电池,则负极反应为 Fe2+-e _=Fe3+ |
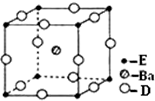 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.