题目内容
2.某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验.Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于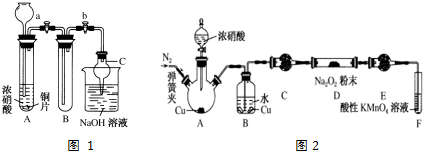
是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2.
(1)甲同学设计如图1装置进行实验:
①试管A中反应的离子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O.
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃.
③仪器C兼有防倒吸的作用,仪器C的名称为球形干燥管.
结论:甲同学认为假设2正确.
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是除去NO2中混有的水蒸气.乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设1正确.则NO2和Na2O2反应的化学方程式是Na2O2+2NO2═2NaNO3.
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化.查阅资料:2NO+Na2O2═2NaNO2;2NaNO2+2HCl═2NaCl+NO2↑+NO↑+H2O;酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+.
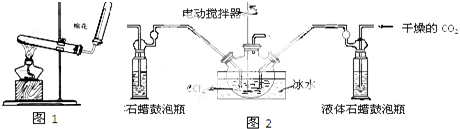
(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应.
①在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排出.
②B中观察到的主要现象是ac(填字母编号).
a.铜片逐渐溶解,溶液变为蓝色b.有红棕色气泡产生c.有无色气泡产生
③C、E中所盛装的试剂不能是a(填字母编号).
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为3:5.
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,加入稀盐酸,产生红棕色气体,则产物是NaNO2.
分析 (1)①Cu与浓硝酸反应生成二氧化氮、硝酸铜和水;
③根据仪器的特征和常见仪器的名称分析C为干燥管;
(2)Cu与浓硝酸反应生成二氧化氮中含有水蒸气;若过氧化钠氧化二氧化氮,则生成硝酸钠,依据氧化还原反应元素化合价变化配平书写发生反应的化学方程式;
(3)①空气中的氧气能氧化NO,实验时要排尽装置中的空气;
②二氧化氮与水反应生成稀硝酸,稀硝酸与Cu反应生成NO;
③无水硫酸铜只能检验水不能吸收水;
④F中为吸收一氧化氮的反应,其氧化剂为高锰酸根,还原剂为NO,根据得失电子守恒判断;
⑤亚硝酸钠中加盐酸会生成NO,NO遇到空气中的氧气会变为红棕色.
解答 解:(1)①Cu与浓硝酸反应生成二氧化氮、硝酸铜和水,其反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
③仪器C具有球形特征的干燥管,所以为球形干燥管,
故答案为:球形干燥管;
(2)Cu与浓硝酸反应生成二氧化氮中含有水蒸气,水蒸气能与过氧化钠反应生成氧气,所以要在A、B之间增加一个装置干燥装置,除去生成NO2气体中混有的水蒸气;若过氧化钠氧化二氧化氮,则生成硝酸钠,其反应的化学方程式为:Na2O2+2NO2=2NaNO3;
故答案为:除去生成NO2气体中混有的水蒸气;Na2O2+2NO2=2NaNO3;
(3)①空气中的氧气能氧化NO,实验时要排尽装置中的空气,所以在反应前,打开弹簧夹,通入一段时间N2,目的是:将装置中的空气排出;
故答案为:将装置中的空气排出;
②在B装置中二氧化氮与水反应生成稀硝酸,稀硝酸与Cu反应生成NO,所以B中观察到的主要现象是:铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;
故选:ac;
③无水硫酸铜只能检验水不能吸收水,
故选:a;
④F中为吸收一氧化氮的反应,其氧化剂为高锰酸根被还原生成二价锰离子降低5价,还原剂为NO被氧化成硝酸根升高3价,则根据得失电子守恒氧化剂与还原剂的物质的量之比为3:5,
故答案为:3:5;
⑤亚硝酸钠中加盐酸会生成NO,NO遇到空气中的氧气会变为红棕色,则检验D装置中物质的方法为:取D装置中产物少许,加入稀盐酸,若产生无色气体,遇到空气变为红棕色,产物是亚硝酸钠;
故答案为:取D装置中产物少许,加入稀盐酸,产生红棕色气体.
点评 本题考查了实验过程分析,物质性质的实验探究,明确物质性质和实验操作的目的和实验步骤分析是解题关键,注意结合题给信息解答解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案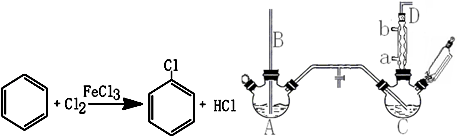
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl和HCl+NaOH=NaCl+H2O(写两个即可).
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
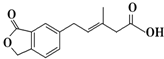
| A. | M可以发生加成、加聚、水解、酯化等反应 | |
| B. | 1mol M最多可以与3mol NaOH反应 | |
| C. | M苯环上的一氯取代物有三种不同结构 | |
| D. | 1mol M最多可以与5mol H2发生加成反应 |
| A. | 该电池充电时,锂极与外电源的负极相连 | |
| B. | 该电池放电时,Li+向负极移动 | |
| C. | 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+ | |
| D. | 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g |
| A. | 1 mol羟基与17 g NH3所含电子数都为NA | |
| B. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g | |
| C. | 常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA | |
| D. | 适量铜粉溶解于1 L 0.5 mol•L-1稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4 NA |
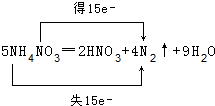 ;5:3.
;5:3.