题目内容
13.氨基甲酸铵(NH2COONH4)是一种易水解、易分解的白色固体,熔点59℃,密度1.6g∕cm3.某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
注:①CCl4与液体石蜡均为惰性介质;
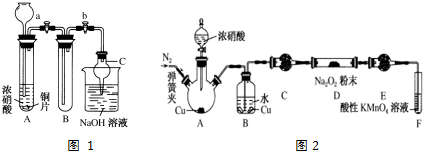
(1)如用图1装置制取氨气,写出制取氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(2)制备氨基甲酸铵的装置图2所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中. 当悬浮物较多时,停止制备.
①发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解)
②液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率).
③从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)此实验操作装置有一个缺陷,如何改进在图2的出气导管末加一个尾气处理装置;
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品5.000g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀为1.5760g.则样品中氨基甲酸铵的质量分数为87.36%.( 精确到2位小数)
分析 (1)在加热条件下,实验室用氯化铵和氢氧化钙制取氨气;
(2)①该反应的正反应是放热反应,降低温度促进平衡正向移动;
②通过观察气泡判断加入物质的量多少;
③生成的氨基甲酸铵的小晶体悬浮在CCl4中,所以可以采用过滤方法分离提纯;基甲酸铵(NH2COONH4)是一种易水解、易分解的白色固体,加热温度要低于其熔点;
(3)氨气有刺激性气味,污染空气;
(4)沉淀的质量是碳酸钡的质量,则n(BaCO3)=$\frac{1.5760g}{197g/mol}$=0.008mol,根据C原子守恒得n(NH4HCO3)=n(BaCO3)=0.008mol,m(NH4HCO3)=0.008mol×79g/mol=0.632g,样品中氨基甲酸铵质量=
5.000g-0.632g=4.368g,从而计算其质量分数.
解答 解:(1)在加热条件下,实验室用氯化铵和氢氧化钙制取氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)①该反应的正反应是放热反应,降低温度促进平衡正向移动,从而提高反应物的转化率,且温度过高也导致产物分解,
故答案为:降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);
②通过观察气泡判断加入物质的量多少,从而控制反应速率,
故答案为:通过观察气泡,调节NH3与CO2通入比例 (或通过观察气泡,控制NH3与CO2的反应速率);
③生成的氨基甲酸铵的小晶体悬浮在CCl4中,所以可以采用过滤方法分离提纯;基甲酸铵(NH2COONH4)是一种易水解、易分解的白色固体,加热温度要低于其熔点,
故答案为:过滤;c;
(3)氨气有刺激性气味,污染空气,所以需要尾气处理装置,故答案为:在图2的出气导管末加一个尾气处理装置;
(4)沉淀的质量是碳酸钡的质量,则n(BaCO3)=$\frac{1.5760g}{197g/mol}$=0.008mol,根据C原子守恒得n(NH4HCO3)=n(BaCO3)=0.008mol,m(NH4HCO3)=0.008mol×79g/mol=0.632g,样品中氨基甲酸铵质量=
5.000g-0.632g=4.368g,其质量分数=$\frac{4.368g}{5.000g}×100%$=87.36%,
故答案为:87.36%.
点评 本题考查制备实验方案设计,为高频考点,涉及气体制备、实验操作、方程式的计算等知识点,侧重考查学生实验操作、对实验原理的理解、基本计算等能力,正确获取信息并运用信息解答问题是解本题关键,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 研发光电转换材料,充分利用太阳能 | |
| B. | 包装材料聚氯乙烯属于烃,会造成环境污染 | |
| C. | 用石灰对煤燃烧形成的烟气脱硫,并回收石膏 | |
| D. | 研发高效生物生长调节剂,减少对化肥的使用 |
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5kJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s);△H=-157kJ•mol-1
则方法a发生的热化学方程式是:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+34.5kJ/mol.
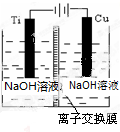
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为阴离子交换膜(填“阴”或“阳”),该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O,钛极附近的pH值增大(填“增大”“减小”或“不变”).
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
| 序号 | 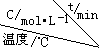 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②实验①前20min的平均反应速率 v(O2)=3.5×10-5mol/(L•min).
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体表面积对反应速率有影响;固体表面积越大,反应速率越快,能表明这一规律另一组实验是1和2(填实验序号).
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填序号).
(3)本实验中影响反应速率的其他因素还有温度,其实验序号是6和7.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:反应物用量相同,放出的热量相同.

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
(1)写出三颈烧瓶A中发生反应的化学方程式
 ;
;(2)为了减少A装置中副反应,操作时应注意迅速地把反应温度提高到170℃左右;
(3)在装置C中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体;
(4)判断D装置中反应已经结束的最简单方法是溴的颜色完全褪去;
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.

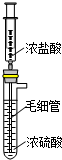 实验室用如图装置制备HCl气体.
实验室用如图装置制备HCl气体.