题目内容
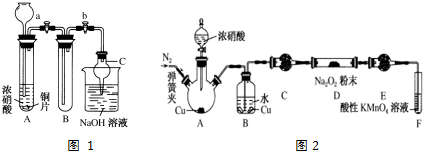
10.氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl和HCl+NaOH=NaCl+H2O(写两个即可).
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
分析 (1)玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;采取逆流原理通入冷凝水;
(2)①反应器C加热控制反应温度在40-60℃,应利用水浴加热;
②由于苯易挥发,反应产生的HCl,且有未反应的氯气,都会在D出口导出;
(3)催化剂氯化铁与氢氧化钠反应,生成的HCl会与氢氧化钠反应,溶解的氯气也会与去氧化钠反应;
(4)A、C反应器之间需要增添干燥装置,干燥生成的氯气,可以用五氧化二磷或氯化钙等;
(5)根据苯的总流失量计算参加反应的苯的质量,再根据苯与氯苯质量定比关系计算.
解答 解:(1)玻璃管B伸入液面下,与大气相通,装置内压强过大时,可用于平衡气压;采取逆流原理通入冷凝水,使冷凝管充满冷凝水,充分冷却,即冷凝水由a口流入,由b口流出,
故答案为:平衡气压;a;
(2)①反应器C加热控制反应温度在40-60℃,应利用水浴加热,
故答案为:c;
②由于苯易挥发,反应产生的HCl,且有未反应的氯气,D出口气体中含有HCl、苯蒸汽、氯气,
故答案为:苯蒸汽;氯气;
(3)催化剂氯化铁与氢氧化钠反应,生成HCl会与氢氧化钠反应,溶解的氯气也会与去氧化钠反应,反应方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O等;
(4)A、C反应器之间需要增添U型管,干燥生成的氯气,可以用五氧化二磷或氯化钙等,
故答案为:五氧化二磷或氯化钙;
(5)苯的总流失量为89.2kg/t,故1t苯中参加反应的苯的质量为(1t-0.0892t),由苯与氯苯质量之比为78:112.5,则生成氯苯质量为:$\frac{(1-0.0892)×112.5}{78}$t,
故答案为:$\frac{(1-0.0892)×112.5}{78}$t.
点评 本题考查有机物制备实验方案,涉及对装置、操作与原理的分析评价、化学计算等知识,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握制备方案设计与评价的原则,试题培养了学生的分析、理解能力及化学实验能力.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案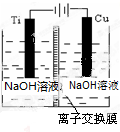 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5kJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s);△H=-157kJ•mol-1
则方法a发生的热化学方程式是:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+34.5kJ/mol.
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为阴离子交换膜(填“阴”或“阳”),该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O,钛极附近的pH值增大(填“增大”“减小”或“不变”).
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0.水蒸气的浓度随时间t变化如下表所示:
| 序号 | 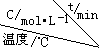 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②实验①前20min的平均反应速率 v(O2)=3.5×10-5mol/(L•min).
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体表面积对反应速率有影响;固体表面积越大,反应速率越快,能表明这一规律另一组实验是1和2(填实验序号).
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填序号).
(3)本实验中影响反应速率的其他因素还有温度,其实验序号是6和7.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:反应物用量相同,放出的热量相同.

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
(1)写出三颈烧瓶A中发生反应的化学方程式
 ;
;(2)为了减少A装置中副反应,操作时应注意迅速地把反应温度提高到170℃左右;
(3)在装置C中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体;
(4)判断D装置中反应已经结束的最简单方法是溴的颜色完全褪去;
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
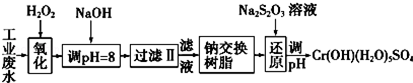
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
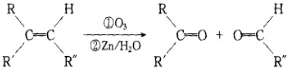
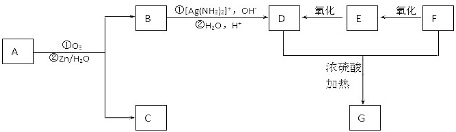
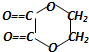 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.