题目内容
12.600K时,庚烷发生反应C7H16(g)$\stackrel{△}{→}$CmHn(g)+CpHq(g)+CxHy(g)(已配平),测得反应前后容器内压强分别是1.01×105Pa和2.02×105Pa(均在600K测定),则庚烷的分解率为( )| A. | 20% | B. | 50% | C. | 66.7% | D. | 80% |
分析 假设开始庚烷为1mol,压强之比等于物质的量之比,计算反应后混合物总物质的量,再根据方程式利用差量法计算分解的庚烷,进而计算庚烷的分解率.
解答 解:假设开始庚烷为1mol,压强之比等于物质的量之比,则反应后混合物总物质的量为1mol×$\frac{2.02×1{0}^{5}Pa}{1.01×1{0}^{5}Pa}$=2mol,
设分解的庚烷为xmol,则:
C7H16(g)$\stackrel{△}{→}$CmHn(g)+CpHq(g)+CxHy(g) 物质的量增大
1 1 1 1 3-2=2
x 2mol-1mol=1mol
所以x=$\frac{1mol×1}{2}$=0.5mol
故庚烷的分解率为$\frac{0.5mol}{1mol}$×100%=50%,
故选:B.
点评 本题考查化学方程式有关计算,关键是明确相同条件下气体压强之比等于物质的量之比,注意运用差量法简化计算,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
7.向甲烷与丙炔的混合气体中加入一氧化碳气体,不论加入一氧化碳的体积如何改变,混合气体的密度始终不会改变(同温同压),则甲烷与丙炔的体积比是( )
| A. | 1:1 | B. | 4:3 | C. | 3:2 | D. | 3:4 |
4.对于苯乙烯(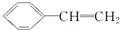 )有下列叙述:
)有下列叙述:
①能使酸性KMnO4溶液褪色;
②能使溴的四氯化碳溶液褪色;
③可溶于水;
④可溶于苯中;
⑤能与浓硝酸发生取代反应;
⑥所有的原子一定共平面.
其中正确的是( )
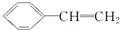 )有下列叙述:
)有下列叙述:①能使酸性KMnO4溶液褪色;
②能使溴的四氯化碳溶液褪色;
③可溶于水;
④可溶于苯中;
⑤能与浓硝酸发生取代反应;
⑥所有的原子一定共平面.
其中正确的是( )
| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | ①②④⑤ |
1.下列各组物质的性质,从左到右依次递减的是( )
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 酸性:HClO4、H2SO4、H3PO4 | ||
| C. | 还原性:HCl、HBr、HI | D. | 原子半径:S、Na、O |
2.下列化学用语的表示正确的是( )
| A. | 过氧化钠电子式: | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: | |
| D. | HClO的结构式:H-Cl-O |
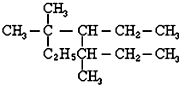 的名称是3,3,5-三甲基-4-乙基庚烷.
的名称是3,3,5-三甲基-4-乙基庚烷.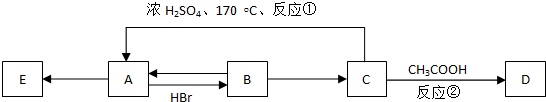
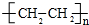 .
.