题目内容
14.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1 mol羟基与17 g NH3所含电子数都为NA | |
| B. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g | |
| C. | 常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA | |
| D. | 适量铜粉溶解于1 L 0.5 mol•L-1稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4 NA |
分析 A.1个羟基含有9个电子,1个氨气分子含有10个电子;
B.根据阳极Cu-2e═Cu2+,电解精炼铜时阳极为粗铜来分析;
C.C2H4、C3H6的最简式均为CH2;
D.根据3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O及气体是否在标准状况下来分析.
解答 解:A.1 mol羟基含有9mol电子,17 g NH3物质的量为1mol,含电子数都为10NA,故A错误;
B.由Cu-2e═Cu2+,每转移NA个电子时,阳极溶解铜的质量为0.5mol×64g/mol=32g,但阳极材料为粗铜,则阳极溶解铜的质量小于32g,故B错误;
C.C2H4、C3H6的最简式均为CH2,故28g混合物中含有的CH2的物质的量n=$\frac{m}{M}$=$\frac{28g}{14g/mol}$=2mol,即含2mol碳原子,即2NA个,故C正确;
D.若为标准状况,由3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O可计算出溶液中氮原子,但不知是否为标准状况,则无法利用NO的体积来计算其物质的量,故D错误;
故选:C.
点评 本题考查有关物质的量及阿伏伽德罗常数的计算,明确电子数等于质子数、物质的化学键、电解精炼铜原理是解答的关键,并注意气体摩尔体积使用条件和对象,题目难度中等.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
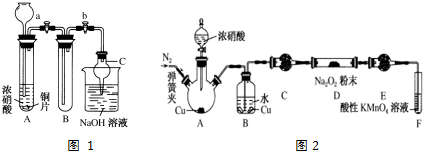
5.实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷,装置如下图所示:
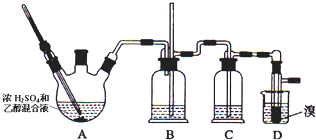
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
回答下列问题:
(1)写出三颈烧瓶A中发生反应的化学方程式 ;
;
(2)为了减少A装置中副反应,操作时应注意迅速地把反应温度提高到170℃左右;
(3)在装置C中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体;
(4)判断D装置中反应已经结束的最简单方法是溴的颜色完全褪去;
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
(1)写出三颈烧瓶A中发生反应的化学方程式
 ;
;(2)为了减少A装置中副反应,操作时应注意迅速地把反应温度提高到170℃左右;
(3)在装置C中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体;
(4)判断D装置中反应已经结束的最简单方法是溴的颜色完全褪去;
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
19.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
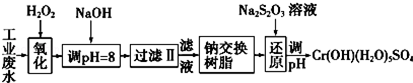
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
6.下列有关物质的性质与其应用不相对应的是( )
| A. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| B. | 新制氯水久置后变为无色 | |
| C. | 单质硅是光导纤维的主要成分 | |
| D. | 普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |
4.对于苯乙烯(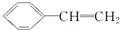 )有下列叙述:
)有下列叙述:
①能使酸性KMnO4溶液褪色;
②能使溴的四氯化碳溶液褪色;
③可溶于水;
④可溶于苯中;
⑤能与浓硝酸发生取代反应;
⑥所有的原子一定共平面.
其中正确的是( )
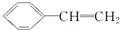 )有下列叙述:
)有下列叙述:①能使酸性KMnO4溶液褪色;
②能使溴的四氯化碳溶液褪色;
③可溶于水;
④可溶于苯中;
⑤能与浓硝酸发生取代反应;
⑥所有的原子一定共平面.
其中正确的是( )
| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | ①②④⑤ |